Obiettivo di apprendimento
1. Identificare i gruppi funzionali aldeide, chetone, acido, estere ed etere.
2. Usare le convenzioni di denominazione appropriate per aldeide, chetone, acido carbossilico e molecole contenenti esteri ed eteri.
Ci sono altri gruppi funzionali che contengono atomi di ossigeno. Un gruppo carbonile si forma quando un atomo di O e un atomo di C sono uniti da un doppio legame. In questo diagramma, il gruppo R rappresenta qualsiasi catena idrocarburica:

Se un legame del gruppo carbonile è fatto ad un atomo di idrogeno, allora la molecola è ulteriormente classificata come aldeide. Quando si nominano le aldeidi, la catena principale di atomi di C deve includere il carbonio del gruppo carbonile, che è numerato come posizione 1 nella catena di carbonio. Si usa il nome principale dell’idrocarburo, ma si aggiunge il suffisso -al. (Non confondere -al con -ol, che è il suffisso usato per gli alcoli.) Così abbiamo

Il metanale ha un nome comune che ti sarà familiare: formaldeide. La cosa principale da notare sulle aldeidi è che il gruppo carbonilico è alla fine di una catena di carbonio.
Un gruppo carbonilico al centro di una catena di carbonio implica che entrambi i legami rimanenti del gruppo carbonilico sono fatti ad atomi di C. Questo tipo di molecola è chiamato chetone. Nonostante il fatto che aldeidi e chetoni abbiano lo stesso gruppo carbonilico, hanno proprietà chimiche e fisiche diverse e sono propriamente raggruppati come due diversi tipi di composti. Il chetone più piccolo ha tre atomi di C. Quando nominiamo un chetone, prendiamo il nome dell’idrocarburo padre e cambiamo il suffisso in -one:
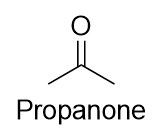
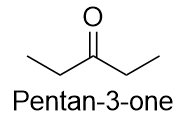
Il nome comune del propanone è acetone. Con i chetoni più grandi, dobbiamo usare un numero locativo per indicare la posizione del gruppo carbonilico appena prima del suffisso, come abbiamo fatto con gli alcheni e gli alchini:
C’è un modo non IUPAC di nominare i chetoni che è anche comunemente usato: nominare i gruppi alchilici che sono attaccati al gruppo carbonilico e aggiungere la parola chetone al nome. Così il propanone può anche essere chiamato dimetilchetone, mentre il butan-2-one è chiamato metiletilchetone.
Esempio 9
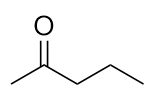
Disegna la struttura del pentan-2-one.
Soluzione
Questa molecola ha cinque atomi di C in una catena, con il gruppo carbonile sul secondo atomo di C. La sua struttura è:
Test Yourself
Disegna la struttura del metil butil chetone.
Rispondi

La combinazione di un gruppo funzionale carbonile e un gruppo idrossile forma il gruppo carbossilico.

Le molecole con un gruppo carbossilico sono chiamate acidi carbossilici. Come per le aldeidi, il gruppo funzionale negli acidi carbossilici è alla fine di una catena di carbonio. Inoltre, come per le aldeidi, l’atomo di C nel gruppo funzionale è contato come uno degli atomi di C che definisce il nome dell’idrocarburo padre. Per nominare gli acidi carbossilici, si usa il nome dell’idrocarburo padre, ma si aggiunge il suffisso -oic acid:

Acido metanoico e acido etanoico sono anche chiamati rispettivamente acido formico e acido acetico. L’acido formico è il composto che fa pungere certi morsi di formica, mentre l’acido acetico è il principio attivo dell’aceto.
Quanto sono acidi gli acidi carbossilici? Si scopre che non sono molto acidi. Nessun acido carbossilico è nella lista degli acidi forti (Tabella 12.2 “Acidi e basi forti”). (Per maggiori informazioni sugli acidi forti, vedi la sezione 12.4 “Acidi e basi forti e deboli e i loro sali”). Questo significa che tutti gli acidi carbossilici sono acidi deboli. Una soluzione 1 M di acido formico è dissociata solo per circa l’1,3% in ioni H+ e ioni formiato, mentre una soluzione simile di acido acetico è ionizzata solo per circa lo 0,4%. Alcuni acidi carbossilici sono più forti – per esempio, l’acido tricloroacetico è dissociato per circa il 45% in soluzione acquosa. Ma nessun acido carbossilico si avvicina alla quantità di dissociazione del 100% richiesta dalla definizione di un acido forte.
Come suggerisce il loro nome, tuttavia, gli acidi carbossilici si comportano come acidi in presenza di basi. L’atomo H del gruppo carbossilico si stacca come ione H+, lasciando uno ione carbossilato:

Gli ioni carbossilati prendono il nome dal nome dell’acido: l’acido -oico è sostituito da -oato per nominare lo ione.
Esempio 10
Completa la reazione chimica. Puoi dare un nome allo ione carbossilato che si forma?

Soluzione
Lo ione OH- rimuove l’atomo H che fa parte del gruppo carbossilico:

Lo ione carbossilato, che ha la formula strutturale condensata CH3CO2-, è lo ione etanoato, ma è comunemente chiamato ione acetato.
Mettiti alla prova
Completa la reazione chimica. Puoi nominare lo ione carbossilato che si forma?

Rispondi

Lo ione è lo ione metanoato, che è comunemente chiamato ione formiato.
Una reazione da considerare è quella tra un acido carbossilico e un alcol. Quando vengono combinati nelle condizioni appropriate, una molecola d’acqua viene rimossa, e i pezzi rimanenti si combinano per formare un nuovo gruppo funzionale, il gruppo estere:

Nota come la molecola di acido contribuisce con un lato alchilico (rappresentato da R), mentre l’alcol contribuisce con l’altro lato (rappresentato da R′). Gli esteri sono nominati usando il nome del gruppo alchilico dell’alcool più il nome del carbossilato dell’acido – per esempio, questa molecola è chiamata metil propanoato.

La chimica è ovunque: Esteri, fragranze e aromi
Gli esteri sono composti molto interessanti, in parte perché molti hanno odori e sapori piacevoli. (Ricorda, non assaggiare mai nulla nel laboratorio di chimica!) Molti esteri si trovano in natura e contribuiscono alla fragranza dei fiori e al sapore della frutta. Altri esteri sono sintetizzati industrialmente e vengono aggiunti ai prodotti alimentari per migliorarne l’odore o il sapore. È probabile che se mangi un prodotto i cui ingredienti includono aromi artificiali, quegli aromi sono esteri. Ecco alcuni esteri e i loro usi, grazie ai loro odori, sapori o entrambi:
| Ester | Sapore/odore come | Ester | Sapori come | ||
|---|---|---|---|---|---|
| allyl esanoato | ananas | isobutyl formate | raspberry | ||
| benzyl acetato | pera | acetato di isobutile | pera | ||
| butil butanoato | ananas | metil fenilacetato | miele | ||
| etil butanoato | banana | nonil caprilato | arancia | ||
| esanoato di etile | ananas | acetato di pentile | mela | ||
| etil eptanoato | albicocca | etanoato di propile | pera | ||
| pentanoato di metile | mela | propil isobutirrato | rum |
Finalmente, il gruppo funzionale etere è un atomo di O legato a due gruppi organici:
R-O-R′
I due gruppi R possono essere uguali o diversi. Nominare gli eteri è come il modo alternativo di nominare i chetoni. In questo caso, i gruppi R sono nominati in modo sequenziale, e la parola etere è aggiunta. La molecola CH3OCH3 è dimetil etere, mentre CH3OCH2CH3 è metiletere. L’etere dietilico, un altro etere, era una volta usato come anestetico, ma la sua infiammabilità e tossicità lo fecero cadere in disgrazia. Le molecole di etere più piccole, che sono liquide a temperatura ambiente, sono solventi comuni per le reazioni chimiche organiche.
Punti chiave
- Aldeidi, chetoni, acidi carbossilici, esteri ed eteri hanno gruppi funzionali contenenti ossigeno.
- La denominazione IUPAC può essere usata per le molecole contenenti aldeidi, chetoni, acidi carbossilici, esteri ed eteri.
Esercizi
-
Nomina una similitudine tra i gruppi funzionali che si trovano nelle aldeidi e nei chetoni. Puoi citare una differenza tra loro?
-
Spiega come un acido carbossilico è usato per fare un estere.
-
Nominare ogni molecola.
a)
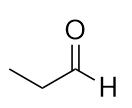
b)
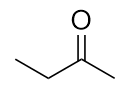
-
Nominare ogni molecola.
a)
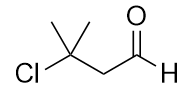
b)
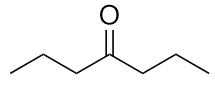
-
Nominare ogni molecola.
a)
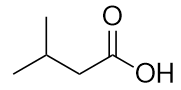
b)
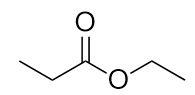
-
Nominare ogni molecola.
a)
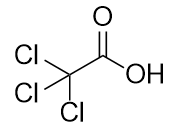
b)
-
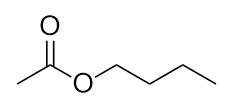
Nominare questa molecola.
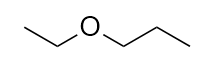
-
Nominare questa molecola.
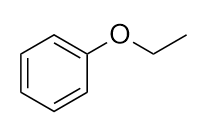
-
Dai un nome alternativo ma accettabile alla molecola dell’esercizio 3.2.
-
Dai un nome alternativo ma accettabile alla molecola dell’Esercizio 4.2.
-
Completa questa reazione chimica.
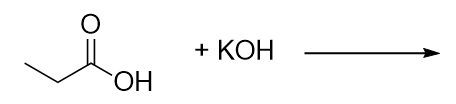
-
completa questa reazione chimica.
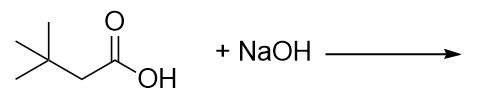
-
Il farmaco conosciuto come aspirina ha questa struttura molecolare:
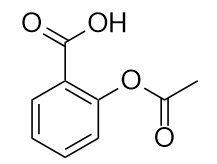
Identifica il/i gruppo/i funzionale/i in questa molecola.
-
Il farmaco conosciuto come naprossene sodico è il sale sodico di questa molecola:
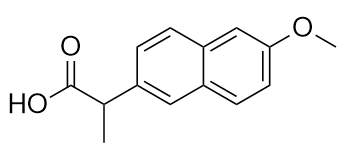
Identificare il/i gruppo/i funzionale/i in questa molecola.
-
Identifica l’estere ottenuto dalla reazione di queste molecole.
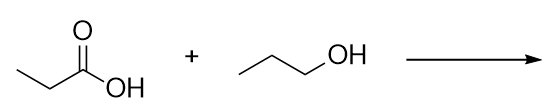
-
Identifica l’estere ottenuto dalla reazione di queste molecole.
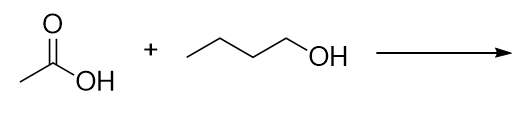
Risposte
1. Entrambi hanno un gruppo carbonile, ma un’aldeide ha il gruppo carbonile alla fine di una catena di carbonio, mentre il carbonio carbonile di un chetone è circondato da altri due carboni.
a) propanal
b) butan-2-uno
a) acido 3-metilbutanoico
b) propionato di etile
7. etere etilico propilico
9. etil metil chetone
11. H2O + KCH3CH2CO213. acido, estere e aromatico (anello benzenico)
15. propionato di propile