Proprietà dei composti ionici
Perché tutti i composti ionici si formano quando anioni e cationi sono attratti l’uno dall’altro, i composti ionici hanno spesso caratteristiche simili.
I composti ionici formano cristalli
I composti ionici sono composti da cationi e anioni che si attaccano l’uno all’altro a causa delle loro cariche opposte. Immaginate un singolo catione di litio attaccato accanto a un singolo anione di cloro per formare cloruro di litio. Ora, è improbabile che solo uno ione litio e uno ione cloruro siano presenti in questa posizione? In generale, quando parliamo di reazioni chimiche, stiamo parlando di un enorme numero di atomi che subiscono una reazione in un luogo molto piccolo (un cucchiaino di sale contiene circa 1022 atomi). Di conseguenza, se la nostra singola coppia di LiCl si avvicinasse ad un’altra coppia di LiCl, accadrebbe quanto segue:
Perché gli ioni di carica opposta si attraggono, le coppie di LiCl tenderanno a formare gruppi più grandi. Questi gruppi più grandi, a loro volta, formeranno gruppi di ioni ancora più grandi, come mostrato nella seguente figura:
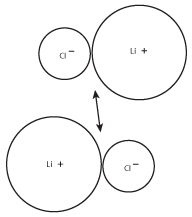
Figura 8.3La carica positiva sul catione litio di una coppia sarà attratta dalla carica negativa sullo ione cloruro dell’altra coppia.

Figura 8.4Questo processo, in cui pile di ioni LiCl si combinano tra loro, continuerà finché non ci saranno più ioni litio o cloruro.
I cristalli sono grandi disposizioni di ioni o atomi che sono impilati in modelli regolari. Molti composti ionici formano cristalli molto grandi.
Queste grandi disposizioni di ioni sono chiamate cristalli. Anche se i cristalli sono spesso formati da composti ionici, esistono anche in alcuni altri composti chimici, come i diamanti. Parleremo di questo in modo molto più dettagliato in Solids.
Gli idrati si formano quando una o più molecole di acqua si attaccano a composti ionici. Questi composti sono interessanti perché appaiono secchi ma emettono acqua quando vengono riscaldati. Particolarmente interessante è il sale di Epsom, o solfato di magnesio eptaidrato (MgSO47H2O). Quando viene riscaldato, viene emessa abbastanza acqua da sciogliere effettivamente il solfato di magnesio!
I composti ionici hanno spesso alti punti di fusione e di ebollizione
Cosa succede quando si riscalda qualcosa in cucina? Potresti aver scoperto cucinando (o cuocendo al microonde cose a caso mentre eri annoiato) che la maggior parte degli alimenti che mangiamo si sciolgono o bruciano quando vengono riscaldati. Alcuni cibi fanno addirittura entrambe le cose! Come probabilmente puoi immaginare, sono un esperto quando si tratta di spegnere gli incendi domestici.
I composti ionici, d’altra parte, spesso si sciolgono e bollono a temperature molto più alte di altri materiali. Affinché i composti ionici si sciolgano, deve essere aggiunta abbastanza energia per far allontanare i cationi e gli anioni l’uno dall’altro. Poiché queste attrazioni sono così forti, ci vuole molta energia per staccare questi ioni. Aggiungere tanta energia ai composti ionici richiede una grande quantità di calore, ed è per questo che i composti ionici hanno punti di fusione e di ebollizione molto alti.
I composti ionici sono duri e fragili
Immagina di sbattere un grosso pezzo di cloruro di litio sulla tua testa. Come pensate che ci si possa sentire? Se avete indovinato che farebbe un male cane, avevate ragione. Come molti composti ionici, il cloruro di litio è duro come una roccia.
I composti ionici sono estremamente duri perché è difficile far muovere gli ioni uno dall’altro in un cristallo. Anche se applichi una grande forza sul cristallo (immagina di correre a capofitto contro un muro gigante di cloruro di litio), l’attrazione tra i cationi e gli anioni continuerà spesso a tenere insieme il cristallo.
Diciamo, però, che vuoi davvero rompere un composto ionico. Anche se molto duri, i composti ionici sono spesso anche molto fragili, il che significa che si rompono quando viene applicato il giusto tipo di forza. Come mostra la figura seguente, dove si applica la forza è importante quanto la quantità di forza che si usa.

Figura 8.5Applicando una forza in un modo che priva i cationi e gli anioni l’uno dell’altro: si può causare la rottura completa di un cristallo.
Come si può vedere da questo diagramma, i cristalli ionici si allineano in modo tale che ci sono regioni dove una piccola forza può rompere il cristallo. Queste regioni sono a volte chiamate “piani di scissione” perché sono i punti in cui il cristallo è più debole e può essere rotto più facilmente.
I composti ionici conducono elettricità quando sono disciolti in acqua o sciolti
C’era una volta un inventore che inventò un dispositivo per asciugare i capelli. Questo “asciugacapelli”, come lo chiamava lui, riscaldava l’aria con l’elettricità e la soffiava sui capelli della persona che lo teneva in mano. Poiché l’acqua evapora quando viene riscaldata, i capelli si asciugavano più rapidamente. L’eredità di questo inventore vive ancora oggi in un elettrodomestico amato da milioni di persone.
Gli elettroliti sono composti che conducono elettricità quando sono disciolti in acqua. Molti composti ionici sono considerati elettroliti. Tuttavia, alcuni composti ionici non si dissolvono in acqua. Di conseguenza, non condividono questa proprietà.
Poco dopo, ci fu un tizio che decise che non voleva aspettare di uscire dalla vasca da bagno prima di asciugarsi i capelli. La sua eredità: Un adesivo di avvertimento dell’asciugacapelli con l’immagine di un tizio folgorato.
Quando i composti ionici sono messi in acqua, fanno sì che l’acqua conduca l’elettricità. Normalmente, l’acqua non conduce affatto bene l’elettricità. Tuttavia, quando i sali si dissolvono in acqua, si scompongono nei loro costituenti cationi e anioni ed è la presenza di questi ioni che permette di condurre l’elettricità. Poiché i sali conducono l’elettricità quando sono dissolti in acqua, sono indicati come elettroliti.
Allo stesso modo, i sali puri conducono anche l’elettricità quando sono sciolti. Come solido, gli anioni e i cationi in un composto ionico sono bloccati in posizione e incapaci di spostare la carica elettrica. Tuttavia, quando il composto ionico viene fuso, questi ioni sono liberi di muoversi e di condurre la carica.
Escritto da The Complete Idiot’s Guide to Chemistry 2003 di Ian Guch. Tutti i diritti riservati, compreso il diritto di riproduzione totale o parziale in qualsiasi forma. Usato in accordo con Alpha Books, un membro di Penguin Group (USA) Inc.
Per ordinare questo libro direttamente dall’editore, visita il sito web di Penguin USA o chiama 1-800-253-6476. Puoi anche acquistare questo libro su Amazon.com e Barnes & Noble.