Fatti, riassunto & Definizione
- Gli enzimi allosterici sono enzimi che hanno un sito aggiuntivo per un effettore da legare oltre al sito attivo
- Gli effettori regolano l’attività dell’enzima – possono attivare o inibire
- Gli enzimi allosterici sono più grandi e più complessi degli enzimi normali
- Sono regolati attraverso una regolazione omotropica o eterotropica
Cosa sono gli enzimi allosterici?
Ricorderete che gli enzimi sono classificati come catalizzatori biologici. Cioè, aiutano ad accelerare il tasso di una reazione, ma rimangono invariati durante l’intero processo.
Gli enzimi allosterici sono enzimi che hanno un sito aggiuntivo, oltre al sito attivo – deriva dal greco ‘allo’, che significa ‘altro’. Questi sono chiamati siti allosterici, e gli enzimi possono averne più di uno. Sono unici in quanto hanno la capacità di rispondere a più condizioni diverse nel loro ambiente immediato. Inoltre, quando gli enzimi allosterici sono mostrati su un grafico come velocità rispetto alla concentrazione del substrato, mostrano una curva sigmoidale piuttosto che la solita curva iperparabolica.
L’immagine sottostante mostra un generico enzima allosterico.

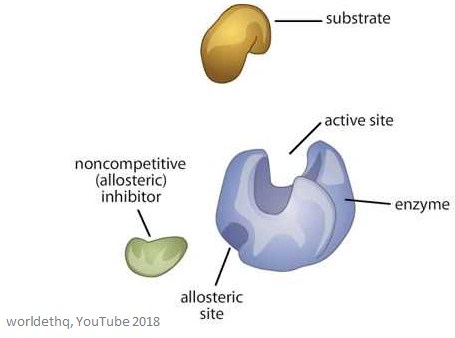
Proprietà degli enzimi allosterici
I siti allosterici sono siti di legame sull’enzima – sono diversi dal sito attivo e dal sito di legame del substrato.
La molecola che si lega al sito allosterico è chiamata effettore (può anche essere chiamata modulatore), e regola l’attività dell’enzima a cui si lega.
L’attività dell’enzima aumenta quando un effettore allosterico positivo si lega al sito allosterico. Questo significa che l’attività dell’enzima è diminuita quando un effettore allosterico negativo si lega al sito allosterico – inibiscono l’enzima.
Gli enzimi allosterici sono più grandi e più complessi degli enzimi non allosterici e spesso hanno molte sub-unità. Gli enzimi con più di un effettore hanno siti di legame diversi e specifici per ciascuno di essi. Nella maggior parte degli enzimi allosterici, il sito di legame del substrato e il sito di legame dell’effettore si trovano su diverse subunità.
Il sito di legame del substrato si trova sulla subunità catalitica – spesso indicata come subunità C. Il sito di legame dell’effettore si trova sulla subunità regolatrice – spesso chiamata subunità R.
Quando una molecola effettrice in un sito di legame causa un cambiamento conformazionale in quella subunità, un cambiamento conformazionale viene poi causato nelle altre subunità della proteina – questo significa che un’enorme porzione di energia di legame dell’effettore viene usata per cambiare la conformazione dell’intero complesso proteico.
Questa interazione tra tutte le subunità può essere espressa usando il coefficiente di Hill – questo è anche chiamato coefficiente di cooperatività. Quando n=1, non ci sarà interazione tra le subunità dell’enzima. Più grande è il coefficiente di Hill (coefficiente di cooperatività), più forti sono le interazioni tra tutte le subunità dell’enzima.
Gli enzimi allosterici possono anche “passare” dalla forma attiva a quella inattiva. Questo permette modelli di risposta sofisticati nell’attività, che possono giocare un ruolo enorme nella funzione biologica. Una volta che l’effettore si dissocia dal sito di legame, l’enzima è in grado di ritornare alla sua forma inattiva (o meno attiva). Possono controllare i tassi di reazioni molto importanti, come la produzione di ATP.
Quando un effettore si lega a un enzima, si parla di legame cooperativo.
Regolazione omotropica
Un effettore allosterico omotropico è un substrato per l’enzima, oltre che una molecola di regolazione – il prefisso “omo” si riferisce al fatto che sono la stessa cosa. Di solito sono attivatori dell’enzima. L’immagine qui sotto mostra un effettore allosterico omotropo.

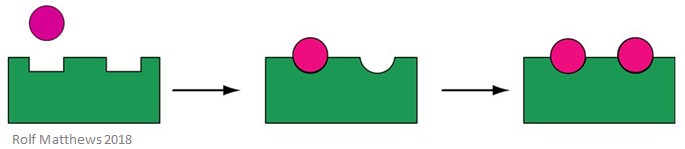
Un buon esempio di un effettore allosterico omotropo è l’ossigeno (O2) – agisce come effettore dell’emoglobina nel corpo umano.
Regolazione eterotropa
Un effettore allosterico eterotropo è una molecola regolatrice che non è anche il substrato dell’enzima. Può attivare o inibire l’enzima a cui si lega. L’immagine qui sotto mostra un effettore allosterico eterotropo.

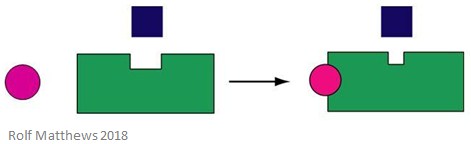
Un buon esempio di un effettore allosterico eterotropo è l’anidride carbonica (CO2) – agisce anche come effettore dell’emoglobina ma non è il substrato dell’enzima.
Attuatori essenziali
Gli attivatori essenziali sono attivatori allosterici che, senza i quali, l’attività dell’enzima sarebbe così bassa da essere trascurabile. Per esempio, l’N-acetilglutammato è un attivatore essenziale per la carbamoil fosfato sintetasi I. Sono l’esatto opposto degli inibitori enzimatici.