Abstract
Background
La diagnosi di infarto miocardico acuto (AMI) è attualmente confermata dalla determinazione della troponina I (pTi) nel plasma. Sulla base dei rapporti precedenti, che le piastrine dei soggetti AMI aggregate da diversi agenti aggreganti non potevano essere inibite dall’acido acetilsalicilico (aspirina), è stata studiata la fattibilità della diagnosi di AMI.
Metodi
Soggetti tra i 40-60 anni con AMI (n=50, M=35, F=15) o ACS (n=30, M=20, F=10) e un numero uguale di volontari normali di pari età e sesso hanno partecipato allo studio. L’inibizione dell’aspirina 80 µM dell’aggregazione piastrinica indotta da 2,0 µM ADP è stata studiata incubando il plasma ricco di piastrine (PRP) con il composto per 30 minuti a 37°C e l’aggregazione è stata eseguita in un aggregometro ottico.
Risultati
Mentre nel caso del PRP normale l’inibizione indotta dall’aspirina era ≈100%. Nel caso di ACS, l’inibizione percentuale è stata del 63,2% rispetto ai casi di AMI dove non è stata trovata alcuna inibizione (cioè 0% di inibizione, p<0,001) da parte dell’aspirina nell’aggregazione piastrinica indotta da ADP (sensibilità= 92% e specificità = 100%).
Conclusione
È stato possibile diagnosticare l’insorgenza dell’IMA grazie all’assenza dell’effetto inibitorio dell’aspirina sull’aggregazione piastrinica.
Parole chiave
aggregazione piastrinica, diagnosi di infarto miocardico, troponina, aspirina.
Introduzione
L’aggregazione delle piastrine da parte di diversi agenti aggreganti piastrinici tra cui ADP, l-epinefrina, collagene o trombina è nota per essere essenziale per il processo salvavita della coagulazione del sangue. D’altra parte, l’eccessiva aggregazione delle piastrine sul sito di rottura della placca aterosclerotica sulla parete dell’arteria coronaria è segnalato per provocare lo sviluppo di trombo, un micro-aggregato di piastrine, che a volte può portare al blocco della normale circolazione del sangue nella muscolatura del cuore, e che di conseguenza può portare alla sindrome coronarica acuta (ACS). Anche se l’aggregazione delle piastrine sul sito di rottura della placca arteriosa può svilupparsi in ACS, l’aggregazione delle piastrine, a volte può anche bloccare l’arteria pericardica che potrebbe causare la morte delle cellule cardiache che è apparso come aree scure patchy di infarti sviluppati a causa della morte delle cellule del cuore che alla fine potrebbe portare a infarto miocardico acuto (AMI), che quando massiccio, potrebbe portare alla morte delle vittime. Gli infarti transmurali dipendono dall’estensione del danno nel miocardio che può o non può essere sempre espresso come onda Q anormale, ma può anche essere coinvolto nella comparsa di onde ST e T anormali nel 50% dei casi nell’ECG con conseguente Infarto Miocardico St-Elevated (STEMI) o non-STEMI, e come tale, l’ECG può non essere diagnosticamente utile per determinare la presenza di AMI. Anche se il dolore al petto è di solito grave e dura più a lungo che nel caso dell’ACS, il dolore stesso è noto per essere di natura soggettiva e può essere un evento simulato diverso dall’AMI stesso. E, come tale, la diagnosi di AMI è solitamente confermata dalla determinazione della troponina I (pTi) nel plasma tramite Enzyme Linked Immuno sorbent Assay (ELISA) usando l’anticorpo della troponina I.
Tuttavia, sia la troponina I (Ti) che il suo anticorpo sono costosi e, inoltre, l’ELISA stesso potrebbe non essere sempre sufficientemente veloce per confermare la presenza di AMI in situazioni impegnative che potrebbero essere necessarie per un possibile intervento terapeutico per la condizione. Per queste ragioni, la diagnosi di laboratorio dell’IMA non è disponibile, non necessariamente per scelta, in molte parti del mondo.
Abbiamo recentemente riportato che il plasma ricco di piastrine (PRP) di pazienti affetti da IMA pre-incubato con 80 µM di acido acetilsalicilico (aspirina), per 30 minuti a 37°C non è riuscito a inibire l’aggregazione delle piastrine iniziata da diversi agenti aggreganti piastrinici, compreso l’ADP, rispetto a quella nel PRP normale o nel PRP da ACS. Sulla base di questi studi preliminari abbiamo studiato la possibilità di confermare il verificarsi di AMI mediante aggregometria ottica anche in assenza della determinazione del pTi.
Riportiamo qui la fattibilità di confermare il verificarsi di AMI differenziato dal verificarsi di ACS determinando l’inibizione indotta da aspirina dell’aggregazione piastrinica indotta da ADP utilizzando un aggregometro. Il verificarsi dell’IMA è stato confermato dalla determinazione parallela e simultanea della pTi mediante ELISA.
Metodi e materiali
Autorizzazione etica
Il progetto di ricerca, ”Diagnosi di laboratorio dell’infarto miocardico acuto mediante aggregometria ottica delle piastrine” ha richiesto una quantità nominale di sangue (2 mL) dai pazienti con AMI o ACS e dai volontari normali. L’Institutional Review Board, Human & Animal Research Ethics Committee, Sinha Institute Of Medical Science And Technology, Kolkata, India ha approvato lo studio a condizione che ha seguito il protocollo etico umano approvato rigorosamente in conformità con la dichiarazione di Helsinki 1964 e nessuna deviazione nello studio è stato permesso senza il permesso scritto precedente del consiglio. Tutti i partecipanti avevano un’età compresa tra i 40 e i 60 anni. Nessun ritardato mentale, donna incinta o prigioniero ha preso parte allo studio. Tutti i volontari hanno firmato un modulo di consenso informato prima della loro partecipazione allo studio. Nei casi di soggetti ACS o AMI, il permesso di partecipare allo studio è stato ottenuto anche dal parente del paziente firmando un affidavit giudiziario. I medici curanti hanno deciso se il campione di sangue (2 ml) poteva essere prelevato dal paziente senza mettere in pericolo il soggetto. Il sangue è stato prelevato dal medico curante o da un infermiere autorizzato. Ci si è assicurati che i volontari non avessero altre infezioni pericolose per la vita. Il comitato ha ispezionato regolarmente i progressi e i problemi dell’indagine in corso.
Prodotti chimici
L’immunoglobulina di capra anti-coniglio G-fosfatasi alcalina e ADP sono stati ottenuti da Sigma Aldrich. Le piastre Enzyme Linked Immunosorbent Assay (ELISA) maxisorp erano della Nunc, Rosaklide, Danimarca. Troponina I, anticorpo Troponina I, CK-MB, anticorpo CK-MB sono stati ottenuti da Abcam. L’acido acetilsalicilico (aspirina) è stato ottenuto da Medica Zydus Healthcare. Tutte le altre sostanze chimiche utilizzate erano di grado analitico.
Selezione dei pazienti AMI
Un numero totale di 50 pazienti (n=50, M=35, F=15, di età compresa tra 40-60 anni con dolore toracico durato >120h ha partecipato allo studio. Questi soggetti sono stati ricoverati nell’unità di terapia intensiva del Calcutta Medical College and Hospital. I pazienti con diabete mellito o infezioni pericolose per la vita non sono stati inclusi nello studio. Poiché la paricardite, l’embolia polmonare, i disturbi aortici e intestinali sono noti per stimolare il dolore toracico dovuto a IMA o ACS, i pazienti con queste condizioni sono stati accuratamente esclusi dallo studio. Tutti i partecipanti che sono stati ricoverati con qualsiasi condizione negli ultimi sei mesi o i pazienti che hanno ricevuto l’aspirina entro 2 settimane sono stati esclusi dallo studio.
Selezione dei volontari normali
Anche un numero uguale di volontari normali di età e sesso corrispondenti sono stati inclusi nello studio. Nessuno dei volontari normali aveva il diabete mellito o una storia di ipertensione sistemica alla presentazione. Nessuno dei volontari normali aveva un’infezione pericolosa per la vita o era stato ricoverato per qualsiasi condizione negli ultimi sei mesi. Nessuna delle volontarie aveva mai ricevuto farmaci contraccettivi. Nessuno dei volontari aveva assunto aspirina o farmaci cardiaci nelle ultime 4 settimane.
Diagnosi di AMI
Tutti i pazienti AMI sono stati ricoverati nell’unità di terapia intensiva cardiaca dell’ospedale con il caratteristico dolore al petto come descritto sopra. I pazienti AMI con STEMI e non-STEMI sono stati inclusi nello studio. Tutti i pazienti selezionati avevano onde Q in via di sviluppo nell’ECG. I casi in cui la comparsa di onde Q nell’ECG non poteva essere chiaramente dimostrata sono stati esclusi dallo studio. L’insorgenza di AMI è stata confermata dai livelli di pTi tramite ELISA.
Diagnosi di ACS
Come parte dello studio previsto, 30 pazienti (n=30, M=20, F=20) tra i 40-60 anni sono stati inclusi nello studio. Questi pazienti avevano un dolore toracico caratteristico. I pazienti che avevano un blocco di branca e le regioni di ischemia cardiaca non potevano essere accertate dall’ECG sono stati esclusi dallo studio.
Il verificarsi dell’ACS è stato confermato dalla determinazione della CK-MB nel campione di sangue prelevando il campione entro 6 ore dall’ammissione in ospedale.
I campioni di sangue sia in caso di AMI che di ACS sono stati ottenuti dai soggetti prima dell’inizio di qualsiasi terapia cardiaca per minimizzare l’ambiguità.
Protocollo di studio
I pazienti selezionati sono stati randomizzati e un numero arbitrario è stato assegnato ad ogni campione di sangue da AMI, ACS e da volontari normali e tenuto sotto la supervisione di un impiegato che non era un investigatore. Lo sperimentatore non sapeva se il campione di sangue prelevato provenisse da un AMI o ACS o da un volontario normale. Solo dopo il completamento dello studio, la “chiave” delle informazioni riguardanti la condizione del partecipante era disponibile agli investigatori per le analisi statistiche. Tutti i campioni di sangue sono stati studiati appena possibile dopo il prelievo del campione.
Preparazione del plasma ricco di piastrine (PRP)
Il PRP dei soggetti è stato preparato mediante centrifugazione come descritto in precedenza.
Il plasma libero da piastrine (PFP) utilizzato per la determinazione di CK-MB o pTi è stato preparato centrifugando i campioni di sangue a 10.000 g a 0°C .
Inibizione dell’aggregazione piastrinica da parte dell’aspirina
Tipo, il PRP dei soggetti con AMI, ACS o dei volontari normali è stato incubato con 80 µM di aspirina per 30 minuti a 37°C. L’aggregazione delle piastrine è stata avviata trattando il PRP con 2 µM di ADP preincubato con o senza aspirina. Negli esperimenti di controllo, il PRP è stato trattato con un volume uguale di 0,9% NaCl incubato a 37°C per 30 min.
Preparazione della soluzione di aspirina
L’aspirina è stata preparata di fresco sciogliendola in acqua deionizzata e il pH è stato mantenuto a 7,0 aggiungendo 0,1M NaHCO3. La soluzione di aspirina è stata scartata dopo l’uso.
Saggio della troponina I e CK-MB plasmatica
I livelli di pTi e CK-MB sono stati determinati tramite ELISA utilizzando l’anticorpo della troponina I e l’anticorpo CK-MB.
Analisi statistica
I risultati ottenuti sono presentati come +/- deviazione standard, mentre la significatività dei risultati è stata determinata utilizzando il test t di Student. Valori di p<0,05 sono stati considerati significativi. Se del caso, sono stati determinati anche i coefficienti di correlazione di Pearson ® dei risultati. Il punteggio di Pearson “r”, è tale che -1 ≤ r ≤ +1 è accettabile dove i segni (+) e (-) sono designati come correlazioni lineari positive e negative, rispettivamente. Il software Graph Pad Prism (Graph Pad Software, San Diego, USA) e il software Micro Cal origin 6.0 sono stati utilizzati per le analisi statistiche. La valutazione dei test diagnostici e l’analisi Receiver Operator Curve (ROC) è stata eseguita utilizzando il software statistico MedCalc, Belgio. Secondo l’analisi ROC un test con discriminazione perfetta (nessuna sovrapposizione in due distribuzioni) ha una curva ROC che passa per l’angolo superiore sinistro (100% sensibilità, 100% specificità). Pertanto, più la curva ROC è vicina all’angolo superiore sinistro, maggiore è la precisione complessiva del test. L’area sotto la curva (AUC) è stata quantificata, che è una misura di quanto bene un parametro può distinguere tra due gruppi diagnostici (malato/normale).
Risultati
L’effetto dell’aspirina sull’inibizione dell’aggregazione piastrinica indotta dall’ADP nel PRP dei soggetti con ACS, AMI e dei volontari normali
Quando il PRP di questi soggetti è stato incubato con 80 µM di aspirina per 30 minuti a 37°C e l’aggregazione piastrinica è stata iniziata trattando il PRP con 2.0µM ADP, si è scoperto che solo nel caso del PRP dei soggetti AMI, il composto non è riuscito a inibire (0% di inibizione) l’aggregazione piastrinica. Al contrario, nel caso di ACS (inibizione percentuale che va dal 52%-68%) o nel caso di PRP normale le piastrine sono state inibite dal 100% (Figura 1, pannello A). L’analisi della curva dell’operatore ricevente (ROC) ha mostrato una sensibilità del 92% (intervallo di confidenza 95% (CI): 91,0-100,0) e una specificità del 100% (CI 95%: 91,0-100,0, P<0,0001). L’area sotto la curva (AUC) testata dall’analisi ROC è risultata pari a 0,952 (Figura 1, pannello B).
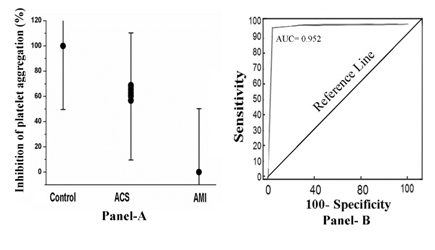
Figura 1. La percentuale di inibizione dell’aggregazione piastrinica e l’analisi della curva dell’operatore ricevitore nel PRP da aspirina nel caso di soggetti normali, ACS e AMI. Pannello A: Il PRP da soggetti normali, ACS e AMI sono stati preparati come descritto in Materiali e metodi e incubati con 80 µM di aspirina per 30 min a 37°C. Dopo l’incubazione, l’aggregazione piastrinica è stata avviata aggiungendo 2 µM ADP e studiata in un aggregometro ottico. Pannello B: Analisi della curva ROC dell’inibizione dell’aggregazione piastrinica in cui la sensibilità è tracciata rispetto alla specificità per diversi punti di cut-off. Ogni punto sulla curva ROC rappresenta una coppia sensibilità/specificità corrispondente a una particolare soglia di decisione come descritto in Metodi e materiali.
Relazioni tra la pTi e l’inibizione indotta dall’aspirina dell’aggregazione piastrinica da ADP in AMI, ACS e in PRP normale.
Come mostrato in (Figura 2, pannello A), l’aumento della pTi è risultato inversamente correlato all’entità dell’inibizione indotta dall’aspirina dell’aggregazione piastrinica. In altre parole, l’aumento di pTi che era massimo nel caso di AMI ha portato anche allo sviluppo della resistenza massima delle piastrine all’effetto inibitorio dell’aspirina (Co-efficiente di correlazione, r di Pearson= -0,967, con p<0.001), e l’inibizione indotta dall’aspirina dell’aggregazione piastrinica era massimamente correlata all’assenza totale di pTi nel normale e il livello di pTi in ACS era più di quello nel plasma normale che dimostrava che la troponina I era presente anche nel plasma ACS anche se meno di quella in AMI. La curva dell’operatore ricevente (analisi ROC) ha mostrato l’85% di sensibilità (95% intervallo di confidenza (CI): 81,0-92,0) e il 78% di specificità (95% CI: 75,0-80,0, P<0,0001). L’area sotto la curva (AUC) testata dall’analisi ROC è risultata pari a 0,739 (Figura 2, pannello B).
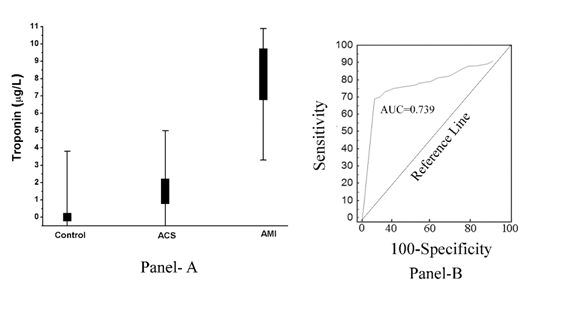
Figura 2. Livello plasmatico di troponina I nei soggetti normali, ACS e AMI e sua analisi ROC. Pannello A: Il livello di pTi è stato determinato tramite ELISA utilizzando l’anticorpo Troponina I come descritto in Materiali e metodi. Ogni punto è in realtà una sovrapposizione di 50 normali, 30 ACS e 50 pazienti AMI. Pannello B: L’analisi della curva ROC dei livelli di pTi in pazienti normali (non malati), AMI (malati) è stata costruita utilizzando MedCalc come descritto in Metodi e materiali.
Discussione
L’infarto miocardico acuto, segnalato come causa di una trombosi che porta alla morte delle cellule cardiache, potrebbe essere senza dubbio il disturbo trombotico più pericoloso che porta a un gran numero di morti tra le vittime. In contrasto con ACS, dove la ricorrenza della condizione è segnalato per essere impedito da aspirina attraverso l’inibizione di aggregazione eccessiva delle piastrine, le piastrine in AMI sono segnalati per essere resistente all’effetto inibitorio del composto a causa della comparsa di dermcidin isoforma-2 (DCN-2) nella circolazione. Purtroppo, a causa della mancanza di inibizione indotta dall’aspirina dell’aggregazione piastrinica, la maggior parte delle vittime della prima volta hanno avuto una recidiva di AMI entro mesi e soccombere alla condizione. Come DCN-2 è stato segnalato per essere un potente inibitore di aspirina indotta ossido nitrico (NO) sintesi. È stato recentemente riportato che rimuovendo il DCN-2 legato dalla superficie piastrinica attraverso una maggiore sintesi di NO nelle piastrine, è possibile risensibilizzare le piastrine AMI all’effetto dell’aspirina.
Non solo il trattamento e la prevenzione dell’AMI attraverso un adeguato intervento terapeutico rimane problematico, anche la diagnosi di laboratorio della condizione, differenziata dal verificarsi di ACS, rimane proibitivamente costosa per molti laboratori nel mondo che è solitamente necessaria per la conferma di AMI dal livello pTi. Questo è dovuto al fatto che sia la troponina I che il suo anticorpo non sono solo costosi, ma il test stesso con ELISA ha bisogno di attrezzature speciali e prodotti chimici necessari e forniture che potrebbero essere una procedura che richiede tempo e in una situazione necessaria in cui una rapida e confermativa presenza di AMI è essenziale per l’intervento terapeutico. Inoltre, l’interazione tra un antigene e il suo anticorpo non segue la nota stechiometria chimica e, come tale, il test stesso può presentare problemi nella validità dell’interpretazione dei dati. Inoltre, la diagnosi di ACS, differenziata da quella di AMI, mediante la determinazione della CK-MB plasmatica è di per sé una procedura costosa.
I risultati presentati sopra hanno fortemente suggerito la fattibilità della diagnosi di AMI, differenziata dalla comparsa di ACS, mediante semplice aggregometria piastrinica utilizzando un normale aggregometro da laboratorio entro un’ora (Sensibilità= 92% e Specificità= 100% come determinato da analisi ROC). La curva del test diagnostico, come descritto in materiali e metodi, passa vicino all’angolo superiore sinistro (Figura 1, pannello B) implicando una precisione vicina al 100% del test diagnostico rispetto alla pTi (Figura 2, pannello B).
Anche perché l’aggregazione delle piastrine nel PRP non può essere inibita dall’aspirina nell’IMA, ma le piastrine dal PRP dei soggetti ACS potrebbero esserlo, la diagnosi dell’IMA tramite aggregometria piastrinica potrebbe essere un evento economico e “tutto o niente”, cioè l’aggregazione delle piastrine nell’IMA può essere inibita dall’aspirina.e. l’aggregazione delle piastrine AMI potrebbe o non potrebbe essere raggiunto affatto dal trattamento di PRP con aspirina, al contrario l’aggregazione delle piastrine dai pazienti ACS potrebbe essere inibita marcatamente dallo stesso composto (Figura 1). Tuttavia, è stato trovato che anche le piastrine da ACS erano un po’ più resistenti all’effetto inibitorio dell’aspirina rispetto a quello delle piastrine normali. D’altra parte, le piastrine dell’AMI erano massimamente resistenti all’effetto dell’aspirina che era inversamente correlata ai livelli di pTi (il coefficiente di correlazione (r) tra il livello di pTi e la % di inibizione dell’aspirina era -0.967, p<0.001).
Dovrebbe essere menzionato nel contesto di cui sopra che una diagnosi rapida e confermativa di AMI è necessaria per l’uso della terapia trombolitica che può ridurre il tasso di mortalità in AMI del 30-50%. Va anche notato che circa il 50% dei pazienti con pTi aumentata non hanno né elevazione ST né onde Q in ECG, e come tale, la diagnosi aggregometrica delle piastrine di AMI potrebbe essere un metodo diagnosticamente ancora più utile di ECG, e allo stesso tempo è molto meno costoso di ELISA per la determinazione pTi.
La quantificazione di pTi nella circolazione dei pazienti AMI è solitamente effettuata come una proteina marcatore di conferma per AMI. Tuttavia, in uno studio preliminare si è scoperto che la pTi è anche un inibitore della sintesi di NO e un potente induttore dell’aggregazione piastrinica in intervalli (nM) simili ai livelli di pTi nel plasma AMI (non pubblicato). Tuttavia, poiché il livello plasmatico della troponina I nell’ACS era superiore a quello del plasma normale, ma molto inferiore a quello dell’AMI, questi risultati suggeriscono che l’aumento della pTi si verifica anche nell’ACS, ma quasi 6 volte inferiore a quello dell’AMI. Questi risultati hanno tuttavia suggerito che l’aumento di pTi rispetto al plasma normale da solo non può necessariamente confermare il verificarsi di AMI differenziato dal possibile verificarsi di ACS.
Abbiamo recentemente riportato che il caratteristico dolore anginoso nell’AMI era legato alla grave riduzione del livello di NO nel plasma che era dovuto all’inibizione della sintesi di NO da parte del DCN-2 o altri inibitori sistemici dell’ossido nitrico sintasi. Poiché il pTi è stato trovato essere un nuovo agente aggregante piastrinico (non pubblicato), attraverso l’inibizione del NOS nelle piastrine, è possibile che il pTi stesso possa essere coinvolto nel dolore anginoso, almeno in parte, nell’IMA. La fuoriuscita di pTi nella circolazione dai muscoli cardiaci potrebbe essere trombogenica di per sé e potrebbe contribuire allo sviluppo di una resistenza all’effetto inibitorio dell’aspirina nelle piastrine dell’IMA simile all’effetto del DCN- 2 con conseguente inizio o aggravamento della condizione. E così, la presenza di pTi potrebbe avere un ruolo infausto nello sviluppo della resistenza all’effetto inibitorio dell’aspirina nelle piastrine nell’IMA che porta alla recidiva della condizione.
- Colman RW, Walsh PN (1987) Haemostasis andthrombosis. In: Colman RW, Hirsh J, Maeder VJ, Salzman EW, eds. Philadelphia, PA (USA), J.B. Lippincott: 594-605.
- Fuster V, Badimon J, Chesebro JH, Fallon JT (1996) Rottura della placca, trombosi e implicazioni terapeutiche. Emostasi 4: 269-284.
- Page DL, Caulfield JB, Kastor JA, DeSanctis RW, Sanders CA (1971) cambiamenti miocardici associati a shock cardiogeno. N Engl J Med 285: 133-137.
- Chakraborty K, Khan GA, Banerjee P, Ray U, Sinha AK (2003) Inibizione dell’aggregazione delle piastrine del sangue umano e la stimolazione della sintesi di ossido nitrico da parte dell’aspirina. Piastrine 14: 421-427.
- Zweig MH1, Campbell G (1993) Receiver-operating characteristic (ROC) plots: uno strumento di valutazione fondamentale in medicina clinica. Clin Chem 39: 561-577.
- Banca S, Jana P, Maiti S, Guha S, Sinha AK (2014) Dermcidin isoforma-2 indotta nullificazione dell’effetto di acido acetilsalicilico in aggregazione piastrinica in infarto miocardico acuto. Sci Rep 4: 5804.
- Ghosh R, Karmohapatra SK, Bhattacharya M, Bhattacharya R, Bhattacharya G (2011) La comparsa di dermcidin isoforma 2, un nuovo agente aggregante piastrinico in circolazione nell’infarto miocardico acuto che inibisce la sintesi di insulina e il ripristino da acido acetilsalicilico dei suoi effetti. J Thromb Thrombolysis 31: 13-21.
- Moreno FL, Villanueva T, Karagounis LA, Anderson JL (1994) Riduzione della dispersione dell’intervallo QT con successo della terapia trombolitica nell’infarto miocardico acuto. Investigatori dello studio TEAM-2. Circolazione 90: 94-100.
- Ghosh R, Ray U, Jana P, Bhattacharya R, Banerjee D, et al. (2014) Riduzione del tasso di morte per infarto miocardico acuto in soggetti con tumori attraverso il ripristino sistemico di ossido nitrico compromessa. PLoS One 9: e88639.