La corrosione è un fenomeno naturalmente distruttivo che si verifica quando alcuni metalli sono esposti all’ambiente. La reazione tra l’aria, l’umidità e il substrato metallico dà luogo a reazioni chimiche specifiche che causano la conversione del metallo nella sua forma più chimicamente stabile di ossido, idrossido o solfuro. Nei metalli a base di ferro, come l’acciaio, la corrosione si presenta sotto forma di ossidi di ferro III, noti anche come ruggine.
Per la corrosione elettrochimica devono essere presenti tre ingredienti: un anodo, un catodo e un elettrolita. L’anodo e il catodo sono solitamente collegati tramite un percorso elettrico continuo mentre entrambi sono immersi nello stesso elettrolita. Durante questo processo, l’anodo sperimenta la corrosione, mentre il catodo rimane inalterato.

Figura 1. Una tipica cella elettrochimica che mostra il flusso di elettroni dall’anodo al catodo attraverso una connessione elettrica. (Fonte: Alksub at the English Wikipedia / CC BY-SA)
Ci sono vari metodi per prevenire e controllare la corrosione. Uno di questi è noto come protezione catodica (CP). Questa tecnica funziona collegando il metallo da proteggere a un “metallo sacrificale” più facilmente corrodibile. Questo metallo sacrificale si corrode preferenzialmente (agendo come anodo) mentre l’oggetto metallico più prezioso in esame (agendo come catodo) rimane protetto. In questo articolo, spiegheremo come funziona questo metodo di protezione sacrificale e descriveremo le sue varie applicazioni.
Comprendere la corrosione galvanica o bimetallica
Per capire come funziona la protezione catodica, dobbiamo prima apprezzare le basi della corrosione bimetallica, conosciuta anche come corrosione galvanica. La corrosione bimetallica, come implica il suo nome, è un tipo unico di corrosione che si verifica tra l’accoppiamento di due metalli. Questa corrosione si osserva in diverse situazioni in cui metalli dissimili sono in contatto diretto o indiretto tra loro. La corrosione bimetallica è solitamente caratterizzata da una corrosione accelerata in un metallo mentre l’altro rimane inalterato. In altre parole, un metallo si sacrifica mentre protegge l’altro. (Questo processo è esaminato più completamente nell’articolo Perché due metalli dissimili causano corrosione?)
La corrosione in una cella elettrochimica è guidata principalmente da una proprietà nota come differenza di potenziale. Questa differenza di potenziale fa sì che gli elettroni fluiscano da un metallo nella cella (l’anodo) all’altro metallo (il catodo) generando una piccola quantità di elettricità nel processo. Quando gli elettroni escono dall’anodo, si verifica l’ossidazione, causando la degradazione o la corrosione del metallo anodico. Nel frattempo, quando gli elettroni fluiscono verso il catodo, si verifica la riduzione, proteggendo ulteriormente il metallo catodico.
Nella corrosione bimetallica, questa differenza di potenziale è un risultato diretto della differenza di potenziale dell’elettrodo tra i due metalli dissimili. Quando un metallo è immerso in un elettrolita, adotta un potenziale di elettrodo che rappresenta la capacità del metallo di essere ossidato o ridotto. Il potenziale elettrodico dei vari metalli è visualizzato in un elenco noto come serie galvanica. (Vedere Un’introduzione alla serie galvanica: Compatibilità galvanica e corrosione per maggiori informazioni). I metalli posizionati più in alto sulla tabella sono considerati anodici (più elettronegativi), mentre i metalli posti più in basso sulla tabella sono più catodici (più elettropositivi). Più distanti sono i metalli a contatto nella serie galvanica, maggiore è la differenza di potenziale tra i metalli, quindi più grave è la corrosione all’anodo.
Protezione catodica (CP) e il suo metodo di funzionamento
Sebbene il design dei sistemi di protezione catodica possa essere sofisticato, il loro funzionamento si basa sul concetto di corrosione bimetallica o galvanica descritto prima. Comprendendo i principi di questo tipo di corrosione, possiamo accoppiare appositamente i metalli per garantire che uno protegga catodicamente l’altro. In altre parole, se vogliamo proteggere una particolare struttura metallica, possiamo creare condizioni in cui questo metallo diventa il catodo di una cella elettrochimica. Collegando elettricamente il metallo da proteggere a un metallo più anodico (elettronegativo), possiamo assicurarci che l’anodo si sacrifichi corrodendo preferenzialmente rispetto alla sua controparte catodica.
In alcuni casi, si possono usare fonti di energia esterne per fornire elettroni aggiuntivi al processo elettrochimico, il che può aumentare l’efficacia della protezione catodica.
I sistemi di protezione catodica sono impiegati in numerose industrie per proteggere una vasta gamma di strutture in ambienti difficili o aggressivi. L’industria del petrolio e del gas, in particolare, usa i sistemi di protezione catodica per prevenire la corrosione negli oleodotti, nei serbatoi di stoccaggio in acciaio, nelle piattaforme offshore e nei rivestimenti dei pozzi petroliferi. Nell’industria marittima, questo metodo di protezione è usato anche su pali in acciaio, moli, pontili e scafi di navi. Un altro tipo comune di protezione catodica, noto come galvanizzazione, è comunemente usato per proteggere membri e strutture in acciaio. (Per saperne di più, leggere Galvanizzazione e la sua efficacia nella prevenzione della corrosione.)
Tipi di protezione catodica (CP)
Come detto precedentemente, la protezione catodica funziona formando intenzionalmente una cella galvanica con un altro metallo sacrificale. Questo può essere ottenuto impiegando due tipi distinti di protezione catodica: protezione catodica passiva e protezione catodica a corrente impressa.
Protezione catodica passiva
Nei sistemi di protezione catodica passiva, l’anodo sacrificale è collegato direttamente o indirettamente al metallo da proteggere. La differenza di potenziale tra i due metalli dissimili genera un’elettricità adeguata per formare una cella elettrochimica e guidare la corrosione galvanica o bimetallica.
Questo tipo di protezione è comunemente usato nell’industria del petrolio e del gas per proteggere i membri strutturali in acciaio delle piattaforme e degli impianti offshore. Qui, le barre di alluminio (o un altro metallo adatto) sono montate direttamente sulle sezioni di acciaio per assumere il ruolo di metallo sacrificale. Scaldabagni in acciaio, serbatoi e pali sono anche protetti catodicamente usando un metodo simile.
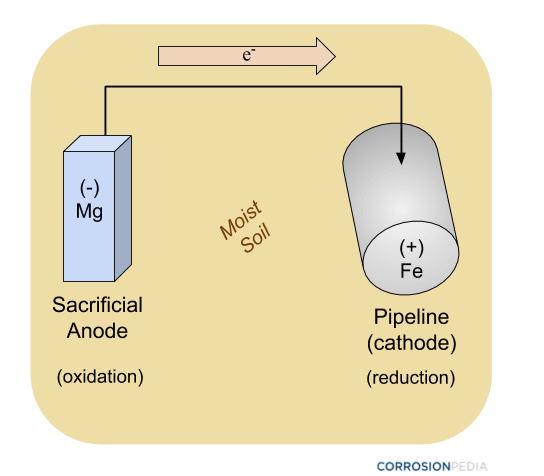
Figura 2. Schema di una conduttura protetta da un anodo sacrificale usando metodi di protezione catodica passiva. Si noti che non c’è nessuna fonte di energia esterna coinvolta.
Un altro esempio comune di protezione catodica passiva è l’acciaio galvanizzato a caldo. Durante questo processo, i membri o le strutture in acciaio sono immersi in un bagno di zinco fuso che ricopre l’oggetto. Quando l’acciaio viene rimosso dallo zinco fuso, reagisce con l’aria e l’umidità per formare uno strato protettivo noto come carbonato di zinco, che crea una cella galvanica con l’acciaio.
Quando il membro in acciaio viene graffiato o danneggiato, in modo tale che il substrato è esposto, il rivestimento di zinco circostante funge da anodo sacrificale e si corrode preferenzialmente per proteggere l’acciaio esposto. Questo tipo di protezione continua fino a quando lo zinco vicino è esaurito.
Protezione catodica a corrente impressa (ICCP)
In grandi strutture, può non essere fattibile usare metodi di protezione catodica passiva. Il numero di anodi sacrificali necessari per fornire abbastanza corrente per una protezione adeguata può essere irrealistico o poco pratico. Per affrontare questo, una fonte di energia esterna viene utilizzata per aiutare a guidare le reazioni elettrochimiche. Questa tecnica è nota come protezione catodica a corrente impressa (ICCP). I sistemi ICCP sono ideali per proteggere le strutture lunghe, come le condutture sotterranee. Le flange dei tubi di collegamento sono solitamente isolate utilizzando kit di isolamento per separare i tubi in sezioni più piccole e gestibili ai fini della protezione ICCP.

Figura 3. Schema di un oggetto protetto da un anodo usando metodi di protezione catodica a corrente impressa (ICCP). Si noti come sia coinvolta una sorgente esterna di corrente continua.
Limitazioni della protezione catodica
Nelle grandi reti di condutture, ci possono essere molti incroci, parallelismi e approcci vicino al sistema CP della conduttura. L’interferenza DC può verificarsi tra le condutture, il che accelera la corrosione. Per superare questo problema, le condutture possono essere accoppiate elettricamente, direttamente o tramite resistenza.
Per le condutture rivestite, il disbondamento catodico può verificarsi a causa di alti livelli di CP dove la qualità del rivestimento applicato è scarsa. Anche le temperature più elevate possono promuovere il disbondamento catodico. Gli ambienti a pH elevato sono anche una preoccupazione in termini di fessurazione da tensocorrosione.
Conclusione
La protezione catodica è un metodo di protezione popolare per prevenire la corrosione nelle condutture, nelle piattaforme petrolifere offshore e in altre strutture in acciaio. Tuttavia, per essere implementata efficacemente, è fondamentale capire i principi di base della corrosione bimetallica/galvanica. La scelta del giusto tipo di sistema di protezione catodica dipende da diversi fattori, tra cui il rapporto costo-efficacia e le dimensioni della struttura da proteggere.