Introduzione
Dalla descrizione clinica iniziale dell’artrite reumatoide (RA), il pannus ha giocato un ruolo chiave nello sviluppo della malattia e la sua comprensione è migliorata insieme allo sviluppo delle tecniche istologiche, di biologia molecolare e di imaging.
Nella clinica, il pannus è stato considerato una manifestazione tardiva, inattiva e irreversibile della malattia, anche se il termine è puramente istologico. La confusione diventa sempre più evidente quando si tratta del monitoraggio clinico dell’AR e l’uso di termini come pannus, sinovite o sinovite cronica, con un’idea confusa sull’attività della malattia.
Per questa revisione è stata condotta una ricerca della letteratura in Pubmed ed Embase, usando i termini pannus, artrite reumatoide, ultrasonografia, risonanza magnetica, dal 1900 al 2015. Sono stati cercati testi non indicizzati e libri sull’argomento, al fine di fare una descrizione narrativa e storica sul pannus, il suo sviluppo e il suo ruolo patologico nell’AR.
La prima descrizione clinica e istologica del pannus nell’artrite reumatoide
Anche se termini simili all’AR erano stati usati prima del 1859, fu Garrod (Fig. 1) che nel capitolo XV del suo libro “The nature and treatment of gout and rheumaticgout “1,2 descrisse accuratamente la malattia come la conosciamo oggi, differenziandola dalla gotta e dalla febbre reumatica. Offrì illustrazioni dettagliate (Fig. 2) delle deformità tipiche e sottolineò la natura grave della malattia rispetto ad altre condizioni, a causa della difficoltà di controllo della malattia e della sua evoluzione clinica invalidante (Fig. 3).

Fotografia di Sir. Alfred Baring Garrod, 1819-1907.3
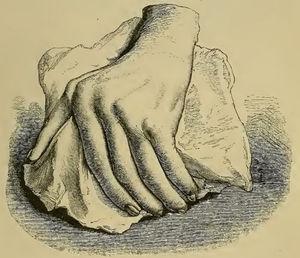
Illustrazione dal libro di Garrod raffigurante una mano deformata con deviazione ulnare risultante da artrite reumatoide.1,2
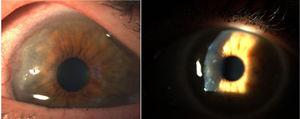
Pannus corneale.8
Nonostante una descrizione clinica molto accurata dell’AR, Garrod non ha menzionato il coinvolgimento articolare dal punto di vista istopatologico. Decenni dopo, William Ord, un medico del St. Thomas’s Hospital di Londra, nel suo manoscritto pubblicato sul British Medical Journal nel 1880, cercò di chiarire alcuni dubbi sul termine RA che, come fece notare, era spesso usato in modo aspecifico per classificare diverse malattie. Ord suggerì che il termine RA doveva essere usato solo per il tipo di coinvolgimento infiammatorio articolare con effusione diverso dalla gotta, dalla febbre reumatica (reumatismo), o dalla scrofola, che è caratterizzata da atrofia ossea e cartilaginea, oltre all’ipertrofia sinoviale. Questa affermazione indicava una relazione con la patofisiogenesi dell’AR.4
Nel 1905 e nel 1909, Nichols e Richardson nel loro lavoro pubblicato nel Journal of Medical Research e nel Boston Medical and Surgical Journal5 rispettivamente, presentarono una delle migliori descrizioni clinico-patologiche delle malattie reumatiche, e differenziarono 2 gruppi di pazienti: uno che descriveva le caratteristiche cliniche simili all’AR e l’altro le caratteristiche dell’osteoartrite.6 Nonostante il fatto che entrambi gli articoli di Nichols e Richardson si riferiscano a casi di artrite deformante non squamosa, la rappresentazione accurata delle manifestazioni cliniche, accompagnata da fotografie e immagini radiografiche, raffigura chiaramente i casi di RA. Questi autori hanno anche compilato un certo numero di campioni istologici da 75 casi clinici, arrivando ad una conclusione importante: ci sono 2 modelli istologici di coinvolgimento articolare, uno di deterioramento della cartilagine articolare, e l’altro di ispessimento della membrana sinoviale. Quest’ultimo è strettamente associato all’invasione del tessuto osseo e della cartilagine articolare, causando distruzione e, occasionalmente, neoformazione ossea disorganizzata. Questa stessa pubblicazione di Nichols e Richardson include una descrizione di artrite proliferativa con formazione di tessuto di granulazione molto vascolarizzato, con una componente cellulare di origine mesenchimale, principalmente della membrana sinoviale e del cosiddetto tessuto simile al pannus. È la prima volta che viene usato il termine pannus articolare.5 Va sottolineato che il termine pannus era già stato usato all’epoca in oftalmologia per descrivere alcuni tipi di lesioni corneali, ed era definito dall’American Academy of Ophthalmology come crescita di tessuto fibroso e vascolare tra l’epitelio e la membrana di Bowman, spesso presente nei casi di edema corneale cronico, in seguito all’infiammazione della cornea7 (Fig. 7). In entrambi i casi, pannus sinoviale e pannus corneale, le lesioni descritte sono simili ad un pannus, la parola latina per “tessuto”.
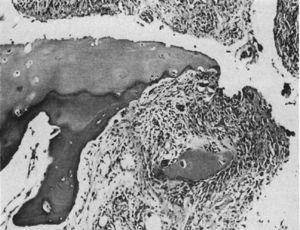
Istologia al microscopio ottico. Lesione distruttiva al margine dell’articolazione interfalangea. Il tessuto sinoviale o pannicolo può essere apprezzato accanto al tessuto di granulazione – il cosiddetto movimento di chiusura che isola un frammento di cartilagine segnato “C”.9
Alcune immagini e descrizioni dello studio di Nichols e Richardson del 19095 sono rappresentate nelle Figg. 4-6.
Fotografia al microscopio ottico della falange distale di un paziente affetto dalla malattia allora chiamata artrite proliferativa di tipo estremo. Mostra la formazione di uno spesso tessuto di granulazione che invade e distrugge la cartilagine articolare.5,6
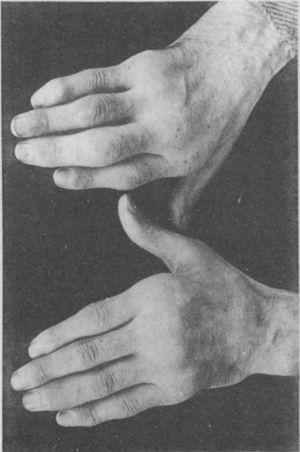
Fotografia delle mani di un paziente di 35 anni con una storia di uretrite gonococcica, che anni dopo ha progressivamente sviluppato una poliartrite delle piccole e grandi articolazioni. Classificata come artrite proliferativa.5,6
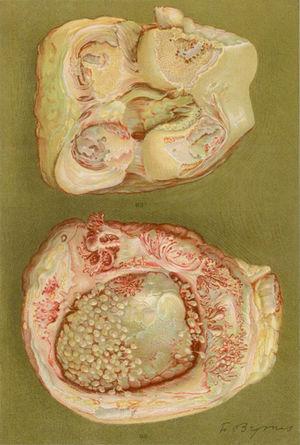
Disegno della necroscopia di una donna di 40 anni con una clinica di poliartrite delle grandi e piccole articolazioni che porta ad una significativa disabilità e anchilosi. C’è evidenza di perdita della cartilagine articolare e di zone di formazione ossea che danno luogo ad anchilosi del ginocchio.5,6
Nel 1959 Kulka pubblicò una revisione della patogenesi dell’AR,9 utilizzando il lavoro di Nichols e Richardson5 come riferimento, che classificò le lesioni istologiche nell’AR in 3 tipi: Il primo tipo fu classificato come alterazioni infiammatorie della membrana sinoviale, il secondo come degenerazione e necrosi del tessuto connettivo, e il terzo come infiltrazione infiammatoria vascolare delle arteriole e delle venule. Il primo tipo di lesioni corrisponde al pannus descritto nel 1909 da Nichols e Richardson, che consiste in un ispessimento sinoviale che causa il riassorbimento della cartilagine. Kulka trovò, utilizzando la microscopia ottica, che da un lato la lesione distruttiva della cartilagine era caratterizzata dalla crescita di tessuto sinoviale cronicamente infiammato – o pannus – e dall’altro, che il tessuto di granulazione che proliferava dagli spazi del midollo osseo subcondrale e si estendeva attraverso la placca subcondrale per attaccarsi al pannus e circondarlo con un movimento a pinza, poteva progredire per isolare frammenti della cartilagine marginale (Fig. 7).9
Kulka nel suo articolo ha definito i criteri istologici per diagnosticare l’AR, se almeno 3 delle 5 caratteristiche distintive sono soddisfatte, in assenza di qualsiasi altra diagnosi probabile:
-
Proliferazione villosa
-
Proliferazione delle cellule sinoviali superficiali, di solito palisading
-
Infiltrazione marcata di cellule infiammatorie (linfociti o plasmacellule) con tendenza a sviluppare noduli linfoidi
-
Residuo compatto di fibrina
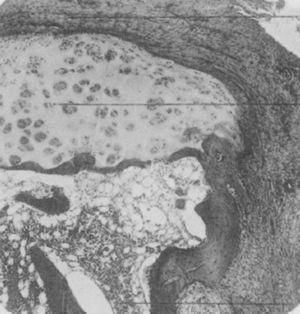
Anche se è stato sottolineato il fatto che nessuna di queste è specifica, la combinazione di 3 o più caratteristiche in assenza di altre patologie aveva un notevole valore diagnostico per l’AR (Fig. 8).

Istologia al microscopio ottico. Sinovite classica del ginocchio nell’AR con ipertrofia villosa, infiltrazione vascolare e noduli linfoidi con un centro germinale nell’angolo destro.9
Microscopia elettronica e modello di tumore del pannus
Nel 1975, Kobayachi e Ziff10 hanno condotto studi al microscopio elettronico sul pannus e sul suo attacco alla cartilagine, per contribuire alla comprensione del danno articolare. Sebbene già nel 196011 Ziff avesse descritto delle alterazioni della membrana sinoviale, entrambi gli autori descrissero che all’interno del pannus potevano svilupparsi delle proteasi lisosomiali che degradavano le mucoproteine della cartilagine e potevano essere secrete in siti specifici, come i margini articolari dove avviene la produzione iniziale del pannus; in altre parole, all’interfaccia della membrana sinoviale e della cartilagine articolare.12
Questi ricercatori hanno analizzato campioni dell’interfaccia sinoviale-cartilagine in 8 pazienti con una diagnosi di RA, e hanno identificato 3 tipi di lesioni: la prima con un’infiltrazione di cellule mononucleari dei vasi che invadono la cartilagine, formando occasionalmente nidi o aggregati di cellule all’interno della matrice cartilaginea (oltre a plasmacellule, linfociti e granulociti). Inoltre, il collagene circolante disciolto è stato trovato anche all’interno di questi nidi, il che ha portato alla teoria della secrezione di un enzima proteolitico (Fig. 9). Il secondo tipo di lesioni corrisponde ad un’invasione diretta della cartilagine da parte di cellule monocitiche e fibroblasti scarsamente differenziati che possono manifestarsi come fagocitari o fibroblastici, con un contenuto granulare amorfo citoplasmatico con prolungamenti cellulari che degradano la matrice cartilaginea del collagene e possono essere visti all’interno dei prolungamenti cellulari (Fig. 10). Il terzo tipo di lesione si presenta come uno spesso strato di tessuto fibroso e vascolarizzato che copre la cartilagine e interferisce con la normale vascolarizzazione della cartilagine articolare.

Immagine al microscopio elettronico che mostra fibroblasti con lisosomi immersi (Lys) ed estensioni citoplasmatiche multiple che invadono la matrice cartilaginea (Ctm).10
Nei due decenni successivi, il ruolo di primo piano del pannicolo nella fisiopatologia della malattia articolare nell’AR non si è limitato a descrivere la distruzione della cartilagine. Edward Harris nel 199013 ha pubblicato una delle revisioni più complete sulla fisiopatologia dell’AR, classificandola in 5 tipi, secondo le caratteristiche immunologiche del danno articolare. Ha descritto che negli stadi iniziali (stadio 2) la sinovia non ispessita e la neovascolarizzazione mediata dalle citochine dei macrofagi14 con accumulo dei linfociti perivascolari hanno un ruolo importante.15 Come precedentemente dimostrato da Kobayashi10 utilizzando la microscopia elettronica, i linfociti – soprattutto T CD4+16 con scarsi regolatori T17 – attivano i linfociti B locali che maturano in plasmacellule produttrici di anticorpi nel tessuto sinoviale,18 compromettendo questo tessuto come parte dell’insorgenza e della progressione della malattia. Harris sosteneva anche che negli stadi più avanzati della malattia (stadio 4) si verificava una proliferazione profusa della sinovia fino a 100 volte il suo peso normale, che veniva interpretata come un comportamento simile a quello di un tumore con una maggiore attività cellulare dei sinoviociti, come è stato confermato in un terreno di coltura arricchito dove le cellule crescevano isolate e in modo autonomo,19 portando a considerare per la prima volta il modello degli oncogeni, come avviene nel cancro.
Componenti cellulari del pannus
Anche se diversi ricercatori hanno continuato a studiare il tessuto ispessito o componente del pannus, nessun accordo è stato raggiunto per quanto riguarda la sua patogenesi. Nel 1983, Burmester et al.20 hanno studiato le cellule non linfocitarie del pannus tramite anticorpi monoclonali mirati contro gli antigeni dei macrofagi e dei fibroblasti. Hanno identificato 3 tipi di cellule della linea della sinovia; le prime erano per lo più (40% del totale) cellule monocitiche o macrofagi con capacità fagocitaria, con espressione di recettori Fc e HLA DR o tipo II. Il secondo tipo di cellule era simile ai monociti, ma non fagocitante, con espressione HLA-DR e nessun altro antigene monocitico trovato. L’ultima linea cellulare trovata era positiva per i marcatori dei fibroblasti, ma senza espressione di HLA-DR o altri antigeni monocitici (tra il 20% e il 40% del totale), il che è stato confermato nel 1987 con cellule clonate e colture cellulari.21 L’importanza di queste cellule sinoviali era, tra gli altri fattori, l’attivazione del proto-oncogene c-jun in risposta allo stimolo dell’IL-a,22 che è simile alle cellule neoplastiche che aumentano l’espressione della collagenasi con la capacità di distruggere, insieme alla stromelysina e altre metalloproteinasi, la matrice cartilaginea e ossea,23,24 una scoperta precedentemente attribuita a Ziff già nel 1960.11
Zvaifler e Firestein25 nel 1994 ritenevano che l’origine del pannus non fosse chiara e che le prove fossero divise in un tessuto sinoviale cronicamente infiammato e un tessuto connettivo specializzato e altamente vascolarizzato che iniziava nell’interfase sinovia-osso e che storicamente era stato definito come il sito di inizio del processo distruttivo.5,10,26,28 In questa revisione sono state considerate due possibilità sull’origine di questi sinoviociti, che sono simili ai fibroblasti e a cui è stato dato il nome di pannociti.20 La prima ipotesi è che le cellule mesenchimali immature siano state le prime a invadere i vasi che penetrano nella cartilagine e che potrebbero essere sostituite o potrebbero evolvere in fibroblasti,27 in un processo mediato da fattori infiammatori sconosciuti (fattore X), indipendenti da fattori derivati dalle cellule T immunitarie, come è stato dimostrato anche in modelli animali.29,30 La seconda ipotesi meno supportata, e basata su studi condotti nei primi anni ‘90,31-33 dipendeva dalle citochine dei linfociti e descriveva la ridotta espressione del genoma dei linfociti e dei prodotti linfocitari nei tessuti e nel liquido sinoviale (Fig. 11).

Percorsi alternativi attraverso i quali il fattore sconosciuto “X” nella RA potrebbe indurre la formazione del pannus. Potrebbe iniziare attraverso la via dipendente dalle cellule T o attraverso la via dei sinoviociti.25
La revisione di Zvaifler e Firestein25 cerca di capire, non solo l’origine, ma il perpetuarsi del pannus, basandosi su 2 possibilità: una – come accennato già nel 1989 – considera un modello tumorale in cui le cellule sinoviali sono trasformate da un segnale che innesca la proliferazione e induce l’espressione di oncogeni e la produzione di enzimi che degradano la matrice o le proteine di adesione.34,35 Questi segnali possono derivare da molecole solubili come le citochine o da agenti eziologici non specificati. Da questa prospettiva, tessuti come la cartilagine o l’osso, non fanno parte del loro sviluppo, ma sono interessati dal pannus. La seconda possibilità si basa sull’idea che i composti generati dai condrociti o dagli immunocomplessi immersi nella cartilagine siano i responsabili dell’attivazione dei sinoviociti per invadere il tessuto e abbandonare il loro ambiente naturale.
Tuttavia, il processo per cui i sinoviociti simili ai fibroblasti, privi di recettori Fc, siano colpiti da questi immunocomplessi36 non è stato stabilito, ma è probabile che le cellule monocitico-macrofagiche siano gli intermediari. Una probabile spiegazione di questo evento è il legame delle proteine del complemento e degli immunocomplessi alla vitronectina e ai suoi recettori, che influenza la differenziazione, la migrazione e la proliferazione dei fibroblasti e che viene successivamente amplificata dal contatto tra queste cellule e il collagene, la fibronectina e altre metalloproteinasi,37,38 attraverso l’espressione di recettori come VCAM-1, che fino ad allora era l’unica molecola di adesione conosciuta sovraespressa nei sinoviociti simili ai fibroblasti.39
Secondo questo secondo scenario, la cartilagine non sarà solo il tessuto colpito dal pannicolo, ma l’induttore e il perpetuatore di questa risposta. Nonostante ciò, è ancora chiaro che la conservazione del pannus dipende dalle citochine che stimolano la crescita cellulare e dalla produzione di enzimi sintetizzati dai sinoviociti derivati dai monociti40 e dai sinoviociti simili ai fibroblasti. È stato dimostrato in vitro che gli enzimi sono sintetizzati41 attraverso la regolazione e l’intermediazione dei linfociti T, dei monociti e dei loro sottoprodotti che rappresentano la maggior parte delle cellule del pannicolo.42
Il lavoro di Burmester nel 198320 è stato fondamentale per la continuità dello studio della componente cellulare del pannicolo. Il gruppo di Xue nel 1997 ha studiato campioni di artroplastica contenenti pannus di pazienti con RA e ha osservato cellule PSC che sono state studiate fenotipicamente tramite microscopia e immunoistochimica, con una specifica espressione proteica e genomica.43 Queste cellule sono risultate positive per i filamenti di vimentina, marker di immunofluorescenza (Fig. 12) ed erano morfologicamente simili ai fibroblasti al microscopio. Tuttavia, il marcatore safranina O che reagisce con i proteoglicani (Fig. 13), così come l’espressione dell’mRNA del collagene di tipo II che è usato per identificare le cellule simili ai condrociti, erano anch’essi positivi; da qui la conclusione che queste cellule sono una combinazione di fibroblasti e condrociti.
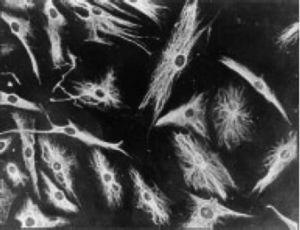
Micrografia in immunofluorescenza che mostra la positività delle cellule PSC agli anticorpi anti-vimentina marcati con isotiocianato di fluoresceina. Questo è simile ai risultati nei fibroblasti.43
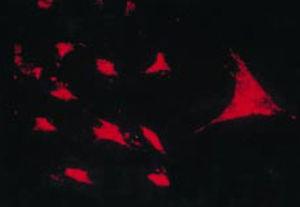
Saggio della trascrittasi inversa in situ per mostrare l’espressione dell’RNA del collagene di tipo II in una coltura di PSC, che trasmette caratteristiche simili ai condrociti.43
Lo studio di espressione del genoma ha anche evidenziato l’alta attività dei proto-oncogeni per c-myc, c-jun e c-fos che permette l’alta produzione di enzimi come la catepsina B e L e alcune collagenasi.
Negli anni successivi sono state divulgate ulteriori prove sulle caratteristiche del tessuto nella malattia articolare precoce e sull’aumento dell’espressione del gene p53,44 mutazioni che erano più spesso viste negli stadi avanzati.45 Nel 2003 Smeets et al. hanno osservato differenze nelle caratteristiche cellulari, nell’espressione delle citochine, dei fattori angiogenici e delle metalloproteinasi del pannus, ottenuto da campioni di pazienti con malattia tardiva sottoposti a sostituzione articolare senza segni di attività clinica dell’artrite, rispetto a pazienti sottoposti ad artroscopia e considerati in fase iniziale della malattia perché avevano ancora attività clinica dell’artrite.46 Le differenze tra i due gruppi erano il maggior numero di macrofagi e linfociti T derivati dai campioni sottoposti ad artroscopia o di malattia precoce, e la maggiore espressione di TNF-a, IL-6, metalloproteinasi (MMP-1, MMP-3, MMP-13) e del fattore di angiogenesi (VEGF).
Il pannus è spesso considerato un tessuto fibroso senza grande attività biologica e un residuo del danno articolare che sembra essere irreversibile. Tuttavia, il pannus si comporta come un mezzo che produce grandi quantità di enzimi proteolitici, con un ruolo patologico centrale, come le MMP 1, 3, 13 e 14.47 La MMP 3 o stromelyn (menzionata sopra)23,24,48 in particolare, è prodotta intensamente come dimostrato nel 200549 attraverso la rilevazione di mRNA alla giunzione sinoviale-cartilaginea, ed è IL-1b dipendente per la stimolazione della sintesi. La MMP 3 differisce dalla MMP 1 o collagenasi di tipo 1, perché è meno abbondante ed è stimolata dal TNF-a.
Panna e fattore nucleare Kappa B
Il fattore di trascrizione nucleare kappa B (NF-kB) è uno dei più importanti regolatori della trascrizione genomica di citochine, chemochine e molecole di adesione; svolge un ruolo nella degradazione della cartilagine e dell’osso articolare,50 è aumentato sia nel tessuto sinoviale dei pazienti che nei modelli animali con RA,51-53 principalmente nella giunzione pannicolo-cartilagine53 dove c’è un maggior numero di cellule produttrici del fattore, rispetto ad altri siti sinoviali fuori da questa giunzione. La rilevanza del fattore NFkB in termini di danno articolare non si riflette solo nell’aumento del numero di citochine, ma nell’osteoclastogenesi – un processo chiave nell’erosione ossea,54,55 che dipende dalla linea mieloide e dal complesso RANK-RANKL,56-58 che permette l’attivazione, la migrazione e la sopravvivenza dell’osteoclasto.59,60 La RANKL deriva dai linfociti T, dai sinoviociti simili a fibroblasti e da cellule esterne all’interfaccia pannicolo-osso.50,61-63 Pettit et al., nel 2006,64 hanno studiato il modello di espressione della RANKL, NF-kB e l’osteoprotegerina (inibitore naturale della RANKL che blocca il suo legame al recettore e quindi impedisce l’osteogenesi) in campioni di pannicolo di pazienti con RA, in particolare dell’interfaccia pannicolo-osso dove non era mai stato studiato. Il risultato è stato che sia la RANKL che l’osteoprotegerina sono espresse nei microambienti dove il pannicolo si interfaccia con l’osso o la cartilagine e c’è erosione o danno tissutale, sempre in proporzioni che favoriscono la maturazione dell’osteoclasta e la sua attivazione. Questo squilibrio molecolare è stato ratificato nel 2008.65
Immagini diagnostiche e pannus
Nel 1978 Cooperberg fu il primo a mostrare la sinovite con gli ultrasuoni, osservando un ispessimento della membrana sinoviale del ginocchio in un’immagine in scala di grigi.66 Ulteriori dettagli furono osservati nel lavoro di De Flaviis nel 1988, implementando un protocollo ad ultrasuoni nella mano di pazienti con RA.67 Passarono 6 anni prima che Newman usasse il metodo Doppler su tendini e borse,68 e 2 anni dopo lo usò per l’ispessimento sinoviale nelle ginocchia di pazienti con RA.69 Natias Hau nel 1999, con ultrasuoni ad alta risoluzione, utilizzò per la prima volta la modalità Doppler sul pannicolo delle mani di pazienti con RA, mostrando l’ipervascolarizzazione70 delle articolazioni del ginocchio, confermando quindi la maggiore vascolarizzazione già descritta in studi condotti un secolo prima (Fig. 14).5,12,14,15
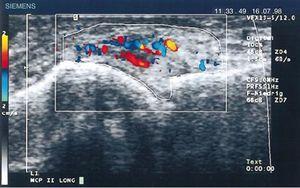
L’ecografia longitudinale dell’articolazione metacarpofalangea mostra le prime immagini Doppler con una maggiore vascolarizzazione del pannicolo in un paziente con RA.70
Avendo mostrato i cambiamenti nel tessuto sinoviale utilizzando gli ultrasuoni, il passo successivo è stato quello di stabilire se questo pannicolo, come visto clinicamente, presenta anche involuzione. Il primo a fare questo tipo di studio ecografico fu Newman nel 1996, quando utilizzò il Doppler in RA69 notando cambiamenti nella quantità di vascolarizzazione dopo la terapia steroidea intra-articolare. Questi stessi risultati sono stati visti nel lavoro di Stone nel 2001.71 Ha confrontato le immagini delle articolazioni metacarpofalangee, prima e dopo la terapia con metilprednisolone per via endovenosa o prednisolone orale. Utilizzando gli inibitori del TNF-a, Hau et al. hanno pubblicato un lavoro nel 2002, mostrando i cambiamenti nella vascolarizzazione del pannus72 nei pazienti trattati con etanercept, e anche in studi successivi.73-76 Taylor ha mostrato il cambiamento dell’ipervascolarizzazione con l’infliximab77 e Naredo ha fatto lo stesso nel 2008.78
L’uso della risonanza magnetica iniziata nel 1988 con il lavoro di Gilkenson ha dimostrato che questo era un metodo migliore per rilevare le erosioni della mano nei pazienti con RA79; Kusunoglu nel 1990 ha dimostrato che era utile per differenziare l’ispessimento sinoviale dal versamento articolare.80 La visualizzazione del pannicolo con questa metodica è iniziata nel 1994, quando per la prima volta Ostergaard ha valutato la crescita sinoviale e la sua relazione con l’attività della malattia,81 confermata da un lavoro più esteso di Sugimoto nel 1998,82 e infine nel 2003 il gruppo OMERACT ha definito la sinovite in risonanza magnetica nucleare come un aumento dello spessore sinoviale in seguito a iniezione di contrasto; questa è sicuramente la prova del pannicolo.83
Conclusioni
La storia ha permesso di comprendere il ruolo critico del pannus nella distruzione articolare, che a volte è simile a una lesione tumorale per la sua crescita rapida e abbondante, favorendo la produzione di anticorpi che perpetuano il processo autoimmune. Questo contraddice l’idea che il pannus sia un tessuto di granulazione poco attivo, limitato ad essere solo un tessuto cicatriziale residuo. Queste caratteristiche interferiscono con i processi di sviluppo, progressione e distruzione dell’osso e della cartilagine articolare che sono stati evidenziati per oltre 100 anni e provati con tecniche di microscopia e biologia molecolare. Pertanto, l’idea che il pannus sia una condizione definitiva o irreversibile non è corretta, poiché non è una parte attiva della malattia e, al contrario, può essere invertita in risposta al trattamento. L’uso scorretto del termine dovrebbe essere evitato per rendere meno confusa la valutazione clinica della malattia. Questi cambiamenti sono stati storicamente attribuiti alla sinovite, che è semplicemente l’infiammazione del tessuto sinoviale valutata clinicamente. Il termine sinovite non può essere differenziato dal pannus, poiché si riferisce a un reperto istologico e quindi il pannus non è compreso nella valutazione clinica iniziale o nel follow-up dei pazienti con RA dalle varie società scientifiche.
Altri studi sul pannus come componente indispensabile della patogenesi dell’AR contribuiranno a una migliore comprensione della malattia fin dal suo inizio, e apriranno nuove strade per la sua valutazione clinica o di imaging, oltre a identificare terapie più mirate che inibiscano la distruzione delle articolazioni.
Conflitto di interessi
Gli autori non hanno conflitti di interessi da rivelare.