La FDA e il CDC, in collaborazione con partner statali e locali, hanno completato l’indagine su due dei tre outbreak multistatali di infezioni da E. coli O157:H7 negli Stati Uniti questo autunno.
Una di queste indagini, Outbreak Unknown Source 3, ha identificato 18 malattie segnalate in nove stati: California, Colorado, Illinois, Michigan, New York, Ohio, Pennsylvania, Virginia, Washington.
FDA ha completato un’indagine di rintracciamento di diversi potenziali veicoli alimentari identificati nelle interviste ai pazienti e, sebbene nessuna singola azienda sia stata identificata come fonte comune del focolaio, FDA e i partner statali hanno anche condotto indagini in loco nelle aziende agricole di interesse. Tuttavia, le informazioni e i campioni raccolti in queste ispezioni non hanno collegato queste aziende all’epidemia. L’indagine su un’azienda agricola non significa che l’azienda sia collegata a un focolaio. I risultati di un’indagine su un’azienda agricola possono portare a escludere quell’azienda dall’indagine. Il 18/12/2020, il CDC ha annunciato che questo focolaio era terminato.
L’altra indagine completata sul focolaio, Outbreak Unknown Source 1, ha identificato 32 malattie riportate in 12 stati: California, Illinois, Louisiana, Maryland, Michigan, Montana, New Jersey, Ohio, Utah, Virginia, Washington, Wisconsin. Questo ceppo di E. coli è geneticamente simile a un ceppo collegato a un focolaio di romaine che si è verificato nella primavera del 2018, anche se un alimento non è stato collegato al focolaio attuale. La FDA ha completato un’indagine di rintracciamento e non è stata in grado di determinare una fonte comune del focolaio. La FDA e i partner statali hanno anche condotto ispezioni in loco nelle aziende agricole di interesse, anche se le informazioni raccolte in queste ispezioni non hanno collegato queste aziende all’epidemia. Il 18/12/2020, il CDC ha annunciato che questo focolaio era terminato.
Le indagini su un terzo focolaio di E. coli di fonte sconosciuta 2 continuano.
Raccomandazione
Consumatori, ristoranti e rivenditori sono stati invitati a non mangiare, vendere o servire la lattuga romana Tanimura & Antle, Inc. confezionata a testa singola con data di confezionamento 10/15/2020 o 10/16/2020.
I prodotti richiamati sono ormai ben oltre la scadenza e probabilmente non sono più sul mercato o nelle case dei consumatori.
Immagini del prodotto

Informazioni sul richiamo
Il 6 novembre 2020, Tanimura & Antle, Inc. ha richiamato la lattuga romana a cespo singolo a marchio Tanimura & Antle, etichettata con una data di confezionamento del 10/15/2020 o 10/16/2020, a causa della possibile contaminazione da E. Coli O157:H7. Le confezioni contengono una singola testa di lattuga romana con il numero UPC 0-27918-20314-9.
Secondo Tanimura & Antle, il prodotto potenzialmente interessato è stato distribuito nei seguenti stati: AK, OR, CA, TX, AR, OK, IN, NE, MO, TN, WI, NM, SC, WA, NC, OH, VA, MA, PR, e IL, ma il prodotto potrebbe essere stato ulteriormente distribuito, raggiungendo altri stati, tra cui il MI.
Il prodotto è stato spedito in casse confezionate in 12, 15, 18 o 24 teste per cassa. I rivenditori e i distributori possono identificare i prodotti potenzialmente interessati attraverso l’adesivo della Produce Traceability Initiative (PTI) attaccato all’esterno della cassa. I codici PTI sono 571280289SRS1 e 571280290SRS1.
Mappa di distribuzione negli Stati Uniti del Tanimura richiamato & Antle, Inc. Single Head Romaine Lettuce
Distribuzione del prodotto*: AK, OR, CA, TX, AR, OK, IN, NE, MI, MO, TN, WI, NM, SC, WA, NC, OH, VA, MA, PR, IL
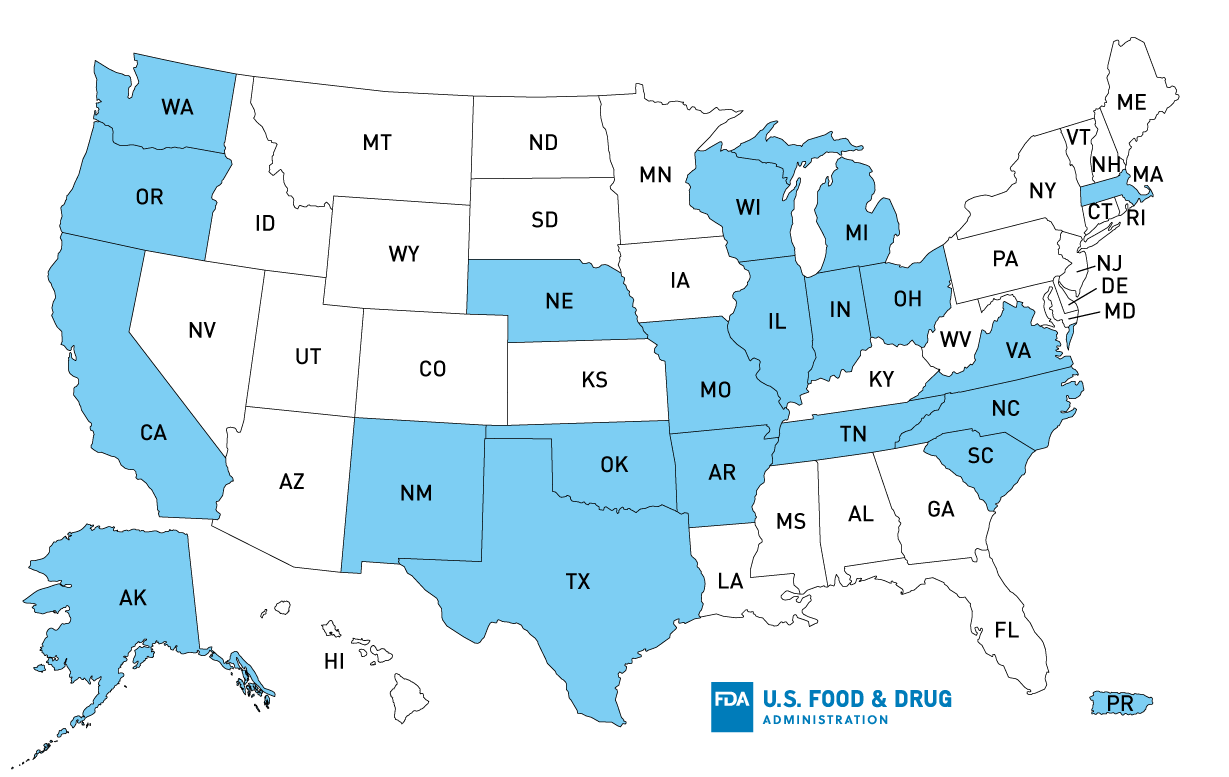
*Stati con distribuzione confermata; il prodotto potrebbe essere stato distribuito ulteriormente
Conteggio dei casi
Per questi focolai, il conteggio dei casi si trova sul sito web del CDC:
- Pagina dei focolai del CDC: Unknown Source 1
- Pagina dei focolai del CDC: Unknown Source 2
- Pagina del focolaio del CDC: Unknown Source 3
Aggiornamenti precedenti
12 novembre 2020
La FDA e il CDC, in collaborazione con i partner statali e locali, stanno indagando sulle malattie in un terzo focolaio multistatale di E.coli O157:H7 questo autunno.
Il 6 novembre 2020, il Michigan Department of Agriculture and Rural Development (MDARD) ha riferito che come parte del campionamento di routine, hanno raccolto un campione di prodotto di lattuga romana per il test. Il campione è risultato positivo all’E. coli O157:H7 e la successiva analisi di sequenziamento dell’intero genoma (WGS) ha determinato che l’E. coli O157:H7 presente nei campioni corrisponde al ceppo che ha causato malattie in questo focolaio.
Il ceppo di E. coli trovato nel campione del Michigan è un terzo ceppo distinto non geneticamente correlato ai ceppi che causano due distinti focolai multi-stato di E. coli O157:H7 (STEC) produttore di tossine Shiga che FDA e CDC hanno annunciato il 28 ottobre 2020. Al momento, un alimento specifico non è stato collegato a nessuno di questi focolai.
Il 6 novembre 2020, Tanimura & Antle, Inc. ha richiamato la lattuga romana confezionata a testa singola con data di confezionamento 10/15/2020 o 10/16/2020 a causa della possibile contaminazione con E. coli O157:H7. L’azienda ha richiamato questo prodotto sulla base dei risultati del test di un campione di prodotto raccolto e analizzato dal MDARD prima che l’analisi WGS che mostra la corrispondenza con il ceppo del focolaio fosse completata.
FDA e i partner statali stanno lavorando con l’azienda per determinare se altre lattughe dovrebbero essere richiamate.
In questo momento, non ci sono abbastanza prove epidemiologiche e di tracciabilità per determinare se le persone malate in questo focolaio sono state esposte alla lattuga romana di Tanimura & Antle, Inc. Ulteriori informazioni saranno fornite non appena disponibili.
Chi contattare
I consumatori che hanno sintomi dovrebbero contattare il loro fornitore di assistenza sanitaria per segnalare i loro sintomi e ricevere cure.
Per segnalare un reclamo o un evento avverso (malattia o grave reazione allergica), è possibile
- Chiamare un coordinatore dei reclami dei consumatori della FDA se si desidera parlare direttamente con una persona del proprio problema.
- compilare un modulo elettronico Voluntary MedWatch online.
- compilare un modulo cartaceo Voluntary MedWatch che può essere spedito alla FDA.