XeF2 è un’abbreviazione del composto chimico Xenon Difluoride. È un potente fluorizzante e un agente ossidante. Oltre allo XeF2, ci sono altri composti dello xeno come lo XeF4 (tetrafluoruro di xeno) e lo XeF6 (esafluoruro di xeno). Di questi composti, lo XeF2 è il più stabile. È un solido cristallino bianco
utilizzato per la fluorurazione nelle procedure elettrochimiche e nei laboratori. XeF2 ha un tipico odore nauseabondo e si decompone quando entra in contatto con il vapore o la luce.
È vitale conoscere la sua struttura di Lewis, l’ibridazione e la polarità per capire le proprietà chimiche e la geometria molecolare del composto. Quindi cerchiamo di capire tutte le proprietà in dettaglio.
Contenuti
Xef2 Struttura di Lewis
La struttura di Lewis di un dato composto chimico è fondamentale per conoscere tutte le proprietà fisiche e chimiche. È una rappresentazione pittorica di tutti gli elettroni che partecipano alla formazione dei legami. Questa struttura aiuta a capire le cariche sulle molecole del composto. Gli elettroni che partecipano alla formazione dei legami, così come quelli che non vi partecipano, sono conosciuti collettivamente come elettroni di valenza.
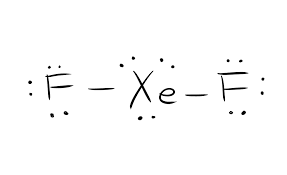
Gli elettroni che prendono parte alla formazione dei legami sono chiamati coppie di elettroni di legame. Quelli che non partecipano alla formazione dei legami sono chiamati coppie di elettroni solitari. Per distinguere tra i diversi tipi di elettroni, sia le coppie di elettroni di legame che quelle solitarie sono rappresentate in modo diverso. La formazione del legame nel composto è rappresentata come linee rette e le coppie solitarie sono rappresentate come punti.
La struttura di Lewis si basa sulla regola dell’ottetto. Questa regola afferma che ogni molecola dovrebbe avere otto elettroni nel suo guscio esterno di un atomo per essere stabile. Se ci sono più elettroni, allora quel composto dona l’elettrone. Mentre se ci sono meno di otto elettroni, il composto accetta gli elettroni dall’altra molecola per essere stabile.
Quindi per questo composto XeF2, c’è una molecola di Xenon e due molecole di Fluoro. Una singola molecola di Xenon ha otto elettroni, e una molecola di Fluoro ha sette elettroni di valenza.
Numero totale di elettroni di valenza = No. di elettroni di valenza per lo Xenon + No. di elettroni di valenza per il fluoro
=8+ 7*2
=8+14
=22
Il numero totale di elettroni di valenza per XeF2=22.
Ibridazione di Xef2

L’ibridazione di una data molecola è vitale per capire la geometria della molecola. Durante la formazione del legame, due o più orbitali con diversi livelli di energia si combinano e creano orbitali ibridi. In XeF2, il guscio esterno dello xeno ha otto elettroni di cui due partecipano alla formazione del legame.
Lo stato fondamentale dello Xenon ha 8 elettroni disposti in orbitali s2 p6. Mentre in XeF2, la molecola di Xe ha uno stato eccitato. La disposizione degli elettroni dello Xenon cambia in s2 p5 d1 con due elettroni spaiati. Quindi l’ibridazione dell’atomo centrale Xe è sp3d. Quindi l’ibridazione della molecola XeF2 è sp3d.
Geometria molecolare di Xef2

Generalmente, la struttura di Lewis è utile per capire la geometria molecolare di qualsiasi composto chimico. Ma poiché lo xeno non forma facilmente dei legami, questo composto è un caso eccezionale. La geometria molecolare del difluoruro di xeno può essere compresa conoscendo la teoria VSEPR. Questa teoria si basa sul numero sterico dell’atomo centrale e sugli elettroni di valenza del composto. VSEPR è l’abbreviazione di Valence Shell Electron Pair repulsion theory.
Qui il numero sterico dell’atomo centrale di Xenon è 5. Questo significa che una singola molecola di Xenon può formare legami con cinque molecole. Ma qui in XeF2, sta formando legami solo con due atomi di fluoro. Per lo xeno, due elettroni su otto formano legami con gli atomi di fluoro. Questi sei elettroni sono ora gli elettroni non leganti. Queste tre coppie di elettroni solitari si distribuiscono in una disposizione che è in posizione equatoriale rispetto alle coppie di elettroni legati.
La forma della molecola dovrebbe essere trigonale bipiramidale come da ibridazione, ma non lo è. XeF2 è una molecola lineare a causa della disposizione degli atomi di fluoro e delle coppie solitarie di elettroni nella disposizione simmetrica.
Angolo di legame
Ora che conosciamo la geometria molecolare della molecola del difluoruro di xeno, l’angolo di legame può essere compreso facilmente. Ci sono due coppie di elettroni legati e tre coppie di elettroni solitari. Le coppie solitarie sono in posizione equatoriale rispetto alle coppie legate. L’angolo di legame tra le due coppie legate all’atomo centrale è di 180 gradi, il che rende la geometria molecolare di XeF2 lineare.
Polarità dello Xef2
![]()
La polarità di qualsiasi molecola dipende dalla geometria molecolare e dall’ibridazione del composto. Nella molecola XeF2, due atomi di fluoro sono disposti simmetricamente all’esterno con l’atomo centrale Xenon al centro. Non c’è alcun momento di dipolo netto nel composto a causa della disposizione degli elettroni di valenza in simmetria. Quindi il difluoruro di xeno è non polare poiché non c’è polarità osservata nella molecola.
osservazioni conclusive
Per riassumere l’articolo, si può concludere che XeF2 ha 22 elettroni di valenza, di cui ci sono tre coppie solitarie di elettroni. La sua ibridazione è sp3d. Secondo la teoria VSEPR, la geometria molecolare della molecola è lineare. L’angolo di legame di F-Xe-F è di 180 gradi. Poiché ci sono molecole di fluoro su entrambi i lati dell’atomo centrale, non c’è momento di dipolo e quindi non c’è polarità. XeF2 è non polare a causa della disposizione simmetrica delle coppie di elettroni legati.