事実・概要 & 定義
- アロステリック酵素とは、活性部位の他にエフェクターが結合する部位を追加した酵素である。
- アロステリック酵素とは、活性部位に加えて、エフェクターが結合する部位が追加された酵素のことである
- エフェクターが酵素の活性を制御する – 活性化または阻害することができる
- アロステリック酵素は、通常の酵素よりも大きく、複雑である
- ホモトロピックな制御またはヘテロトロピックな制御によって制御される
アロステリック酵素とは何か?
酵素が生物学的触媒に分類されることを覚えているでしょう。
アロステリック酵素とは、活性部位のほかにもう1つの部位を持つ酵素のことで、ギリシャ語で「その他」を意味する「allo」に由来しています。 これはアロステリックサイトと呼ばれ、酵素は1つ以上のサイトを持つことができます。 アロステリックサイトは、身近な環境にある複数の異なる条件に対応する能力を持っているという点でユニークです。
下の画像は、一般的なアロステリック酵素を示したものです。

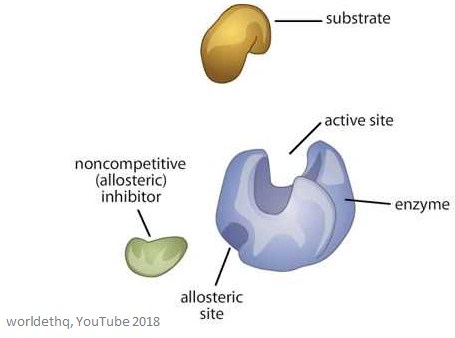
アロステリック酵素の特性
アロステリックサイトとは、酵素上の結合部位のことで、活性部位や基質結合部位とは異なります。
アロステリックサイトに結合する分子はエフェクター(モジュレーターとも呼ばれる)と呼ばれ、結合した酵素の活性を調節します。
正のアロステリックエフェクターがアロステリックサイトに結合すると、酵素の活性が上がります。
アロステリックな酵素は、非アロステリックな酵素よりも大きくて複雑で、多くのサブユニットを持っていることが多いです。
アロステリック酵素は、非アロステリック酵素よりも大きく複雑で、多くのサブユニットを持っています。 ほとんどのアロステリック酵素では、基質結合部位とエフェクター結合部位は異なるサブユニット上にあります。
基質結合部位は触媒サブユニット(Cサブユニットと呼ばれることが多い)上にあります。
基質結合部位はCサブユニットと呼ばれる触媒サブユニット上にあり、エフェクター結合部位はRサブユニットと呼ばれる制御サブユニット上にあります。
エフェクター分子がある結合部位でそのサブユニットにコンフォメーション変化を起こすと、タンパク質中の他のサブユニットにもコンフォメーション変化が起こります。つまり、エフェクターの結合エネルギーの大部分がタンパク質複合体全体のコンフォメーションを変化させるために使われるのです。
このすべてのサブユニット間の相互作用は、Hill係数で表すことができ、これは協同性係数とも呼ばれます。 n=1の場合、酵素のサブユニット間には相互作用がありません。
アロステリック酵素は、活性型と不活性型を「切り替える」こともできます。
また、アロステリック酵素は、活性型と不活性型を「切り替える」ことができます。 エフェクターが結合部位から解離すると、酵素は不活性型(または低活性型)に戻ることができます。
エフェクターが酵素に結合することを協力的結合といいます。
ホモトロピック制御
ホモトロピックアロステリックエフェクターは、酵素の基質であると同時に制御分子でもあり、「ホモ」という接頭語は両者が同じであることを意味します。 通常、酵素の活性化因子です。 下の図は、ホモトロピックアロステリックエフェクターを示しています。

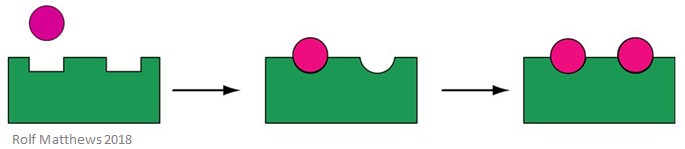
ホモトロピックアロステリックエフェクターの良い例が酸素(O2)で、人体のヘモグロビンのエフェクターとして働きます。
異方性調節
異方性アロステリックエフェクターとは、酵素の基質ではない調節分子のことです。 異方性アロステリックエフェクターは、酵素の基質ではなく、結合した酵素を活性化したり、阻害したりすることができます。 下の図は、異方性アロステリックエフェクターを示しています。

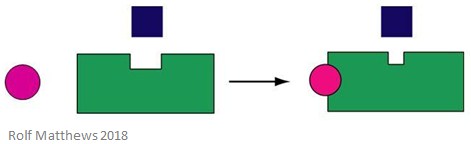
異方性アロステリックエフェクターの良い例が二酸化炭素(CO2)で、ヘモグロビンのエフェクターとしても機能しますが、酵素の基質ではありません。
必須活性化因子
必須活性化因子とは、アロステリックな活性化因子で、これがないと酵素活性が無視できないほど低くなってしまうものです。 例えば、N-アセチルグルタミン酸はカルバモイルリン酸合成酵素Iの必須活性化剤であり、酵素阻害剤とは正反対のものである。