DNA損傷

DNA損傷は、癌として知られる悪性新生物の主要な基礎原因であると考えられています。 悪性新生物におけるDNA損傷とDNA修復遺伝子のエピジェネティックな欠損
DNA損傷は、がんとして知られる悪性新生物の主要な原因であると考えられています。 癌への進行におけるその中心的な役割は、このセクションの図の中で、一番上の枠内に示されています(癌への進行におけるDNA損傷、エピジェネティックな変化、DNA修復の欠損の中心的な特徴は、赤で示されています)。 DNA損傷は非常に一般的なものです。 自然発生的なDNA損傷(主に細胞の代謝と体温での水中のDNAの性質による)は、ヒトの細胞1個あたり、1日平均60,000個以上の新しい損傷が発生します。 さらに、外因性の物質にさらされることでもDNA損傷が生じます。 タバコの煙は外因性のDNA損傷を増加させ、このDNA損傷が喫煙による肺がんの原因と考えられています。 また、太陽光線による紫外線は、メラノーマに重要なDNA損傷を引き起こします。 ヘリコバクター・ピロリ菌の感染は、DNAを損傷する活性酸素を大量に発生させ、胃がんの原因となる。 また、高脂肪食を食べている人の大腸で高濃度に存在する胆汁酸も、DNAを損傷し、大腸がんの原因となります。 桂野らは、炎症を起こした大腸の上皮に存在するマクロファージや好中球が、大腸の腫瘍化の原因となるDNA損傷を引き起こす活性酸素種の供給源であることを指摘している。
34のDNA修復遺伝子のいずれかに欠損を引き起こす生殖細胞系列の突然変異を持つ個体(DNA修復欠損症の記事を参照)は、癌のリスクが高くなります。 DNA修復遺伝子の生殖細胞系列の突然変異の中には、生涯で最大100%の確率でがんになるものがあります(例:p53の突然変異)。
悪性新生物の約70%は遺伝的要素がなく、「散発性がん」と呼ばれています。
悪性新生物の約70%は遺伝的要素がなく、「散発性がん」と呼ばれています。散発性がんのうち、DNA修復遺伝子の変異によってDNA修復が欠損しているものはごく少数です。 しかし、大多数の散発がんでは、DNA修復遺伝子の発現を低下させたり、沈黙させたりするエピジェネティックな変化によって、DNA修復機能が欠損している。 例えば、113例の連続した大腸がんのうち、DNA修復遺伝子MGMTにミスセンス変異があったのは4例のみで、大部分はMGMTプロモーター領域のメチル化(エピジェネティックな変化)によりMGMTの発現が低下していました。 5つの報告では、大腸がんの40%から90%がMGMTプロモーター領域のメチル化によりMGMTの発現が低下しているという証拠が提示されています。
同様に、DNA修復遺伝子PMS2の発現が欠損しているミスマッチ修復欠損大腸がん119例のうち、6例ではPMS2遺伝子の変異によりPMS2が欠損しており、103例ではプロモーターのメチル化によりペアリングパートナーであるMLH1が抑制されているためにPMS2の発現が欠損していました(PMS2タンパク質はMLH1がないと不安定になります)。
さらに、DNA修復遺伝子であるBRCA1、WRN、FANCB、FANCF、MGMT、MLH1、MSH2、MSH4、ERCC1、XPF、NEIL1、ATMについて、13%〜100%の頻度でエピジェネティックな欠損が見つかった。 これらのエピジェネティックな欠損は、様々ながん(乳がん、卵巣がん、大腸がん、頭頸部がんなど)で発生していました。 Facistaらが評価した49の大腸がんでは、ERCC1、XPF、PMS2の発現欠損が2つまたは3つ同時に発生しています。
DNA修復遺伝子の発現が低下すると、細胞内に通常よりも多くのDNA損傷が蓄積され、これらの過剰な損傷によって突然変異やエピミューテーションの頻度が増加します。
DNA二本鎖切断の修復やその他のDNA損傷の修復の際に、修復部位が不完全にクリアされると、エピジェネティックな遺伝子サイレンシングの原因となります。
複数の変化を伴う正常に見える組織である電界欠陥 (以下のセクションで説明します) は、悪性新生物の無秩序で不適切に増殖する組織のクローンが発生する一般的な前駆体です。 このような分野の欠陥(図の下から2段目)には、複数の変異やエピジェネティックな変化がある可能性があります。
がんが形成されると、通常、ゲノムが不安定になります。 この不安定性は、DNA修復の低下や過剰なDNA損傷が原因と考えられます。
いったんがんが発生すると、ゲノムが不安定になります。 例えば、9つの領域で採取された腎癌には、腫瘍の不均一性を示す40のユビキタス変異(すなわち、癌のすべての領域に存在する)、一部の領域で共有される59の変異(すべての領域ではない)、および癌の1つの領域にのみ存在する29の「プライベート」な変異がありました。
Field DefectsEdit
この現象を表現するのに、「フィールドエフェクト」、「フィールドガン化」、「フィールド発がん」など、さまざまな言葉が使われてきました。 圃場癌化」という言葉は、1953年に初めて使われました。これは、上皮の領域または「圃場」が、(当時はまだほとんど知られていなかった)プロセスによって、癌の発生に適した状態になっていることを表しています。 それ以来、「field cancerization」や「field defect」という言葉が、新たな癌が発生しそうな前悪性組織を表すのに使われるようになりました。
field defectは癌への進行において重要です。 しかし、ほとんどのがん研究では、Rubinが指摘しているように「がん研究の大部分の研究は、in vivoでは明確に定義された腫瘍を、in vitroでは個別の新生物病巣を対象に行われてきた。 しかし、ミュータント表現型のヒト大腸腫瘍に見られる体細胞変異の80%以上が、末端のクローン拡大が始まる前に発生しているという証拠がある。 同様に、Vogelsteinらは、腫瘍で確認された体細胞変異の半分以上が、見かけ上は正常な細胞の成長過程において、新生物になる前の段階(フィールドディフェクト)で発生したことを指摘している。 同様に、腫瘍に見られるエピジェネティックな変化は、新生物になる前の電界障害で生じた可能性があります。
電界効果の拡大解釈は「病因的電界効果」と呼ばれ、新生物になる前の細胞における分子的および病理学的変化だけでなく、外因性の環境因子や局所的な微小環境における分子的変化が、腫瘍の発生から患者の死に至るまでの新生物の進化に及ぼす影響を包含しています。
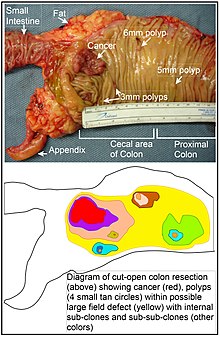
大腸では、おそらく、大腸の内側にある腸管クリプトの基部にある幹細胞の中から、変異またはエピジェネティックに変化した細胞が自然淘汰されることで、場の欠損が生じます。 変異した幹細胞やエピジェネティックに変化した幹細胞が、自然淘汰されて近くの他の幹細胞に置き換わるのかもしれない。 このようにして、異常な組織のパッチが生じることがある。 このセクションの図には、切除したばかりで縦に開いた大腸の一部の写真があり、そこには大腸がんと4つのポリープが写っています。 写真の下には、変異した細胞やエピジェネティックに変化した細胞の大きなパッチがどのように形成されたかを示す模式図があり、図中の黄色の大きな領域で示されています。 この最初の大きなパッチ(細胞の大きなクローン)の中で、2回目の変異やエピジェネティックな変化が起こり、ある幹細胞がパッチ内の他の幹細胞と比較して優位性を獲得し、この変化した幹細胞がクローン的に拡大して、最初のパッチの中に2番目のパッチ(サブクローン)を形成することがあります。 これは、図では大きな黄色の元の領域の中に、異なる色の4つの小さなパッチで示されている。 これらの新しいパッチ(サブクローン)の中で、このプロセスは何度も繰り返されます。4つの二次パッチ(図では色が異なる)の中のさらに小さなパッチがクローン的に拡大し、幹細胞が発生して小さなポリープか、あるいは悪性新生物(がん)が発生するまで、このプロセスは繰り返されます。
この写真では、大腸の一部分に明らかな視野欠損があり、4つのポリープ(ポリープの大きさを6mm、5mm、3mmのものが2つと、最長で約3cmの大きさのがん)が発生しています。 これらの新生物は、写真の下の図でも、4つの小さな褐色の円(ポリープ)と大きな赤い部分(癌)で示されています。 写真の癌は、大腸が小腸と結合する部分(ラベル)と、虫垂がある部分(ラベル)である、大腸の盲腸部に発生しました。 写真の脂肪は、大腸の外壁の外側にあります。 ここに写っている大腸の一部分では、大腸を縦に切り開いて、大腸の内側の表面を露出させ、大腸の内側の上皮内に発生している癌やポリープを表示しています。
散発性大腸癌が発生する一般的なプロセスが、自然選択によって広がる前腫瘍性クローンの形成、続いて最初のクローンの内部でのサブクローンの形成、さらにその内部でのサブサブクローンの形成であるとすれば、大腸癌は一般的に、前悪性事象の連続を反映した、異常性が増大する領域と関連し、それが先行するはずである。
がんの特異的なDNA修復欠損を実験的に評価したところ、多くの特異的なDNA修復欠損が、それらのがんを取り巻くフィールドの欠陥でも発生することが示されました。 下の表は、がんのDNA修復欠損がエピジェネティックな変化によって引き起こされることが示された例と、同じエピジェネティックな原因によるDNA修復欠損が周囲のフィールド欠陥で発見される頻度がやや低い例を示しています。
| がん | 遺伝子 | がんでの頻度 | 野外欠陥での頻度 | Ref. |
|---|---|---|---|---|
| Colorectal | MGMT | 46% | 34% | |
| Colorectal | MGMT | 47% | 11% | |
| 直腸癌 | MGMT | 70% | 60% | |
| 直腸癌 | MSH2 | 13% | 5% | |
| 直腸癌 | ERCC1 | 100%td | 40% | |
| 直腸癌 | PMS2 | 88% | 50% | |
| 直腸癌 | XPF | 55% | 40% | |
| 頭頸部 | MGMT | 54% | 38%td | |
| 頭・首 | MLH1 | 33% | 25% | |
| 頭・首 | MLH1 | 31% | 20% | |
| 胃 | MGMT | 88% | 78% | td |
| 胃 | MLH1 | 73% | 20% | |
| 食道 | MLH1 | 77%-。100% | 23%-79% |
開腹された結腸セグメントの写真に写っている野外欠損の小さなポリープの一部は、比較的良性の新生物である可能性があります。
ゲノムの不安定性
がんは、ゲノムの不安定性や変異体の表現型を示すことが知られています。 核の中にあるタンパク質をコードするDNAは、ゲノムDNA全体の約1.5%を占めています。 乳がんや大腸がんでは、このタンパク質をコードするDNA(エクソームと呼びます)の中に、タンパク質を変化させる変異が60~70個程度存在し、そのうち3~4個が「ドライバー」変異、残りが「パッセンジャー」変異であると考えられています。しかし、乳がんの組織サンプルに含まれるゲノム全体(タンパク質をコードしない領域を含む)のDNA配列変異の平均数は約20,000個です。 平均的なメラノーマの組織サンプル(メラノーマはエクソーム変異頻度が高い)では、DNA配列変異の総数は約80,000です。
がんにおける全塩基配列の変異頻度が高いことから、がんの原因となる場の欠陥(例:このセクションの図の黄色の部分)の初期の変化が、DNA修復の欠陥であることが多いと考えられます。 Facistaらは、大腸がんの周囲に見られる大きな電界障害(がんの両側に約10cmずつ伸びている)について、電界障害の領域全体で、2つまたは3つのDNA修復タンパク質(ERCC1、XPF、PMS2)のエピジェネティックな欠損が頻繁に見られることを示した。 DNA修復機能の欠損は、突然変異率の上昇を引き起こす。 DNA修復の欠損は、それ自体がDNA損傷を蓄積させ、それらの損傷の一部を過ぎたエラーを起こしやすいトランスレッション合成が、突然変異を生じさせる可能性があります。 さらに、蓄積されたDNA損傷の修復がうまくいかないと、エピミュータンスが発生することがあります。 これらの新たな突然変異やエピミュータントは、増殖上の利点をもたらし、現場での欠陥を発生させる可能性があります。 DNA修復遺伝子の突然変異やエピ変異は、それ自体は選択的優位性を与えるものではありませんが、細胞が増殖的優位性をもたらす追加の突然変異やエピ変異を獲得する際に、細胞内の乗客として連れて行かれる可能性があります。