- 背景
- 原因
- 疫学
ビタミンK依存性凝固因子の複合欠損症(VKCFD)は、先天性の疾患としてごく稀に発生する。 先天性VKCFDは2つのタイプのうちの1つとして遺伝し、どちらも常染色体劣性のまれな出血性疾患です。 後天的なビタミンKの欠乏、特に肝疾患、吸収不良、栄養不良、あるいは多くの薬剤(特にワルファリンやワルファリン誘導体の過剰摂取)に起因する、血液凝固第二因子(FII)、FVII、FIX、FX(およびタンパク質C、S、Z)の複合的な活性低下という、より一般的な臨床症状があります。
ビタミンK依存性タンパク質(VKDP)の機能は、タンパク質のアミノ末端領域(Glaドメイン)にあるいくつかのグルタミン酸残基の正常なγ(ガンマ)カルボキシル化に依存しています1。この反応には、ビタミンKの還元型から酸化型への正常な循環と、その後の還元型ビタミンKの再生が必要です2, 3。 3 これらの反応は、小胞体(ER)に存在する2つの酵素、すなわち、Ireman-glutamyl carboxylase(GGCX)とビタミンK 2,3エポキシド還元酵素複合体サブユニット1(VKORC1)の働きによって達成される。 VKCFDの2つの変異型は、これら2つのタンパク質をコードする遺伝子の欠損によって生じるものであり、血液凝固因子の本質的な欠損によるものではありません。 GGCXの活性が低下するとVKCFD1となり、VKORC1の活性が低下するとVKCFD2となります。 VKCFDの最も一般的な臨床症状は、乳児期の重篤な出血ですが、欠損の程度は非常に多様で、小児期から成人期にかけてVKCFDを呈することもあります4,5。 さらに、VKCFDでは、凝固以外の生物学的システムに影響を及ぼすVKDPのカルボキシル化不足や機能不全が一般的であり、その発現には大きなばらつきがあり、出血表現型よりもかなり遅い時期に臨床的特徴を示す可能性があることが認識されつつあり、VKCFDの監視と管理にも影響を与えています。
McMillanとRobertsは、1966年に先天的なカルボキシル化欠損に起因する臨床的な出血の最初の症例を報告しました6,7。この合併症のない妊娠の女性児は、生後1週間であざができ、生後1カ月間は臍の切り口から繰り返し血がにじみ出ていました。 来院時のプロトロンビン時間(PT)は95秒、部分トロンボプラスチン時間(PTT)は305秒であった。 患者の血漿と正常血漿を1対1の割合で混合したところ、これらの検査値はいずれも正常範囲に完全に補正され、臨床的には新鮮凍結血漿(FFP)を1回注入しただけで臍からの出血が止まりました。 血小板数、フィブリノゲン、FVおよびFVIIIは正常でしたが、FII、FVII、FIXおよびFXの活性はすべて検出下限値(<3%)を下回っていました。 ビタミンK1の経腸投与を開始したところ、軽度の打撲傾向が見られただけで、子供は正常に成長・発達した。
その後の半世紀の間、VKCFDと診断されることは非常に稀でした。 VKCFD1(VKDP凝固因子の低下を伴うGGCXの遺伝的欠損)の最も包括的な報告例は30家系以下であり、5,7 VKCFD2については4家系が報告されています8 欠損の程度は報告例によって様々です。 欠損したFII、FVII、FIX、FXの特定の組み合わせにより、トロンビン生成に複数のレベルの欠陥が生じます。 基質であるプロトロンビンの活性自体が低下し、さらに、組織因子/FVIIaおよびテナーゼ複合体を介したトロンビン生成も障害されます。 凝固カスケードの内在性経路、外在性経路、共通経路のそれぞれにおけるタンパク質の欠損は、PTおよびaPTTのスクリーニング検査の延長に反映されます。 軽度の症例では、PTの延長がaPTTの延長よりも顕著な場合があります。 しかし、VKCFDの一般的な症状と重篤な合併症は、血栓症よりもむしろ出血によるものです9。
VKCFDの完全な病因は、19910,11年にStaffordらが、2004年にOldenburgらが、GGCXタンパク質をコードする遺伝子をクローニングし、その特徴を明らかにした後に明らかになりました12,13,14。 VKCFD1はグルタミルカルボキシラーゼ遺伝子(GGCX)の変異に起因するもの、VKCFD2はVKOR複合体遺伝子(VKORC1、またはVKOR)の変異に起因するものとされています15,16,17
ビタミンKには3つの形態があります。
- ビタミンK1(フィロキノン)は、植物や藻類によって生産され、緑黄色野菜に大量に含まれている重要な食物性ビタミンです。 ビタミンK1は、ビタミンA、D、Eとともに、脂溶性ビタミンです。
- 正常な腸内細菌叢はビタミンK2(メナキノン)を産生する。
- ビタミンKの合成物は、水溶性を高めた薬効成分としてビタミンK3(メナジオン)と呼ばれています。
ビタミンK依存性タンパク質はすべて、カルボキシグルタミン酸を多く含むGlaドメインを含んでおり、このドメインの翻訳後修飾を適切に行うための補因子としてのビタミンKの役割は、タンパク質の正常な機能に不可欠である。 凝固に関与するタンパク質に加えて、様々な生物学的プロセスがビタミンK依存性タンパク質(VKDP)の影響を受けており、カルボキシル化不足の表現型が出血性および非出血性の症状と関連している可能性があることがますます理解されている。 臨床症状」参照)抗凝固タンパク質CおよびSの炎症への関与に加えて、単球/マクロファージにおけるGla-rich protein(GRP)の作用が、炎症と石灰化の相互作用に関与している。 骨芽細胞由来のVKDPであるオステオカルシンは、グルコース代謝に関与し、正常な骨形成と骨強度に関連している。 さらに、細胞増殖の制御(Growth Arrest Specific gene 6 protein, Gas6)や、血管の石灰化や組織のミネラル化の抑制(Matrix Gla protein, MGP)にも関与しているが、膜貫通型Glaタンパク質(TMG)やプロリンリッチGlaタンパク質(PRGP)など、いくつかの追加的なVDKDPの機能については現在のところ不明である。2,18,19,20
血液凝固因子II、VII、IX、X、およびタンパク質C、S、Zは、それぞれのGlaドメインのアミノ酸配列に9から13個のグルタミン酸(Glu)を含んでいる。 これらのグルタミン酸の翻訳後のカルボキシグルタミン酸(Gla)への修飾が不十分であることが、VKCFDの両バリアントで欠損している酵素のステップである。 Glaドメインのカルボキシル化は、カルシウム依存性の構造を与える。この構造は、タンパク質がリン脂質(例えば、活性化血小板のリン脂質表面)や内皮細胞と正常に相互作用するために不可欠である。 GGCXは、この翻訳後修飾を行うタンパク質であるが、補酵素として還元型ビタミンKも必要である。 還元型ビタミンKは反応の過程でビタミンKエポキシドに変換され、還元型はVKORの作用により触媒反応のサイクルを重ねるために再生されなければならない。 VKORは抗凝固剤であるワルファリンによって阻害されるため、ワルファリンを服用している人は還元型ビタミンKの再生が阻害され、ビタミンK欠乏症やVKCFDと同様の結果となり、カルボキシル化が過剰になり、FII、FVII、FIX、FXの機能が低下する。
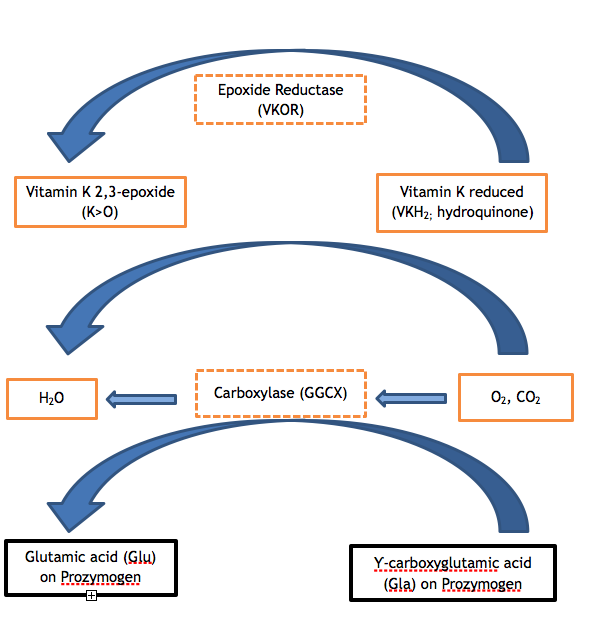
Figure 1. ビタミンKサイクル。 ビタミンK依存性タンパク質の適切な機能には、ザイモジェンのグルタミン酸残基のカルボキシル化が必要である。 カルボキシラーゼ(GGCX)は、ビタミンKが必須の補酵素である反応において、二酸化炭素分子をGluに加えてGlaを形成する。 その際、還元型ビタミンK(ハイドロキノン)が酸化され、ビタミンK 2,3-エポキシドが生成される。 還元型ビタミンKは、VKORの酵素作用によりエポキシドから再生され、その後のカルボキシル化反応の補酵素として利用できるようになる。 VKORまたはGGCXのいずれかの酵素の活性が低下すると、VKCFDになります(図のハッチボックスを参照)。
このように、VKDPは正常に合成・分泌されますが、翻訳後のカルボキシル化が不十分なため、タンパク質の機能に異常が生じることが明らかになりました。
膜タンパク質であるGGCXやVKORC1の精製には困難が伴い、その結晶構造も解明されていません。
GGCXとVKORC1の精製は困難で、結晶構造も解明されていませんが、これらのタンパク質の機能ドメインについては理解が進んでいます1。 5,8,21,22
第2染色体のp腕にあるGGCX遺伝子は、758アミノ酸(AA)の膜貫通タンパク質をコードしており、小胞体の膜上に局在している。 酵素のN-末端部分は細胞質に存在する。 5つの膜貫通型ドメインが続き、小胞体の脂質膜に局在する。 タンパク質のC-末端部分は小胞体の内腔内にある。 この内腔内領域には、ビタミンKとの相互作用に重要な疎水性ドメインが存在する。重要な機能ドメイン(AA491-507と提案されている)は、VKDPのプロペプチドと相互作用し、もう一つのVKDPのグルタミン酸との結合領域(AA393-404)は、γ-カルボキシル化を促進する。 実際、VKCFDの臨床表現型とGGCX遺伝子の変異との最初の相関関係には、グルタミン酸結合領域の394位がロイシンからアルギニンに置換されていることが記載されていた15。 ここで紹介するタンパク質は、完全長のGGCX遺伝子から発現されている。 23
16番染色体のVKOR遺伝子は163AAの膜貫通タンパク質をコードしています。 VKORタンパク質の基本的な膜トポロジーについては議論があります。例えば、このタンパク質には3つの膜貫通ドメインがあるのか、4つの膜貫通ドメインがあるのか、また、ビタミンKに対する求核攻撃のための高度に保存されたVKOR C132XXC135活性部位は細胞質にあるのか、それとも小胞体内腔にあるのか、といった議論が続いています。 重要な構造領域には、AA98と100のアルギニン部位が含まれ、VKORを必要な活性部位に局在させるために必要なジアルギニンER保持モチーフを構成している。 VKCFD2では、単一のVKOR変異(VKORC1p.Arg98Trp)がすべての症例を占めているため、還元酵素の機能的な酵素相互作用を理解するための遺伝子型と表現型の相関関係が存在しない(VKCFD1の場合と同様の可能性がある)。 1,8,24,25
これらのタンパク質の作用を修飾する追加の遺伝子がまだ未確認である可能性もあります。 動物実験では、GGCXとVKORの両方をノックアウトしたマウスの胚が致死したことから、すべての組織に独立した冗長なカルボキシラーゼ経路が存在するわけではないことが示唆されています26,27。 VKORタンパク質が同定された当時、RostらはVKOR-like 1 (VKORL1)と名付けられたパラログタンパク質を同定しており、このタンパク質はK>O;13ビタミンK拮抗薬による抗凝固療法中に肝外組織でビタミンKの機能を一部救済する役割があることが示唆されている1。 VKORL1が凝固因子の肝カルボキシル化をサポートする上で重要な生理的役割を果たしていることを示唆するデータはないため、現時点ではこのパラログタンパク質はVKCFDには関係ないと考えられています。 VKCFD1(GGCXの遺伝子変異が凝固因子活性の低下と関連して存在する)の最も包括的な発表例には、33人の罹患者(26人の別々のプロバンド)が含まれています。