緩衝剤の働き
溶液のpHを計算する際に見たように、pHを劇的に変化させるには少量の強酸が必要です。 しかし、実験によっては、反応や実験者が酸や塩基を加える間、pHを一定に保つことが望ましい場合があります。 化学者は、反応のpHを調整するためにバッファを日常的に使用している。
緩衝剤は、弱酸とその共役の塩基、または弱塩基とその共役の酸の混合物です。
緩衝剤とは、弱酸とその共役塩基、または弱塩基とその共役酸の混合物のことで、酸や塩基が加わると反応してpHを調整します。 例えば、弱塩基のアンモニア(NH3)とその共役の酸(NH4+)で構成される緩衝剤の作用を考えてみましょう。 この緩衝液に塩酸を加えると、NH3は酸のプロトンを吸収してNH4+となる。 同じ緩衝液にNaOHを加えると、アンモニウムイオンが塩基にプロトンを供与して、アンモニアと水になります。このとき、緩衝液は塩基を中和する役割も果たします。 強酸のプロトンは弱酸であるアンモニウムイオンに置き換わり、強塩基のOH-は弱酸に置き換わる。 強い塩基であるOH-は、弱い塩基であるアンモニアに置き換わります。
Calculating the pH of Buffered Solutions
緩衝剤は、コントロールする必要のある適切なpH範囲に合わせて選択しなければなりません。 緩衝液のpH範囲は、Henderson-Hasselbalch式で与えられます。 ここでは、酸(HA)とその共役塩基(A-)からなる緩衝液を考えてみましょう。 酸の解離定数pKaは次の式で与えられることがわかっています:

この式は次のように並べ替えることができます。
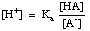
この式の-logを取り、各項が正になるように並べ替えると、ヘンダーソン-ハッセルバルフの方程式が得られます。