このチュートリアルでは、炭酸イオンのルイス構造を順を追って描いていきます。 全価電子の概念は、CO32-のルイス構造を描くために使用されます。 CO32-のルイス構造を完成させた後は、-2の電荷と安定性があるはずです。
炭酸イオン|CO32-
炭酸イオンは-2の電荷を持っています。 金属の炭酸塩化合物は世の中にたくさんあります。 例えば、CaCO3が挙げられます。
CO32- ルイス構造
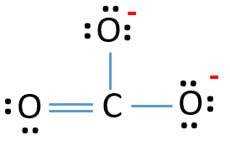
CO32- イオンのルイス構造には、炭素原子の周りに3つのσ結合とπ結合があります。
Steps of drawing lewis structure of CO32-
CO32-のルイス構造を描くには以下のステップが必要で、このチュートリアルで詳しく説明します。
- 炭素原子と酸素原子の価電殻の電子数の合計を見つける
- 電子ペアの合計
- 中心原子の選択
- 原子にローン・ペアを置く
- 安定性をチェックし、ローン・ペアを結合に変換することで原子の電荷を最小化する。
CO32-の共鳴構造を正しく描くためには、正しいルイス構造を描くことが重要です。
CO32-の価電子の総数
炭素は周期表の第4族に位置しています。 また、酸素は第6族に位置しています。
- 炭素原子が与える価電子の総数 = 4
CO32-イオンには酸素原子が3つ含まれているので
- 酸素原子が与える価電子の総数 = 6 *3 = 18
CO32-イオンには-2の電荷がある。
CO32-イオンには-2の電荷があるので、価電子に寄与する電子はさらに2個あります。
- 総価電子数 = 4 + 18 + 2 = 24
総価電子対
総価電子対 = σ結合 + π結合 + valence shellsのlone pair
総価電子対は、総価電子数を2で割って求めます。
CO32-イオンの中心原子
中心原子になるためには、より高い価数を持っていることが重要です。
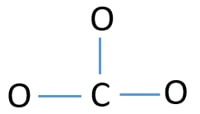
CO32-イオンの中心原子
中心原子になるためには、より高い価数を持つことが重要であり、炭素は価数が4であるため、中心原子になる可能性が高くなります(図参照)。
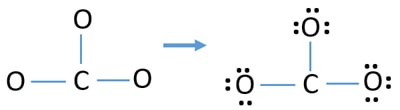
Lone pairs on atoms
- 上のスケッチにはすでに3つのC-O結合があります。
- まず、この9つの価電子ペアを、外部の原子(酸素原子上)のローンペアとしてマークします。
- まず、その9個の価電子対を外部の原子(酸素原子上)にローンペアとしてマークします。1個の酸素原子は8進法(酸素原子は価電子を8個以上保持できない)に従って3個のローンペアを取ります。
- 酸素原子3個で9個の電子対が使われているので、酸素原子(外側の原子)に印をつけた後、炭素原子に印をつけるローンペアはもうありません。
Charges on atoms
原子の電子対に印をつけた後、各原子の電荷に印をつける必要があります。 イオンの最適なリーウィス構造を決定するためには、電荷のマーキングが重要です。
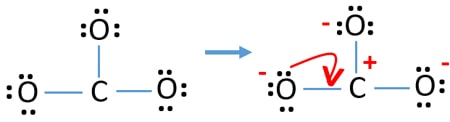
安定性を確認し、ローンペアを結合に変えることで、原子の電荷を最小にします
- 酸素原子は炭素原子よりも電気陰性度が高いので、負の電荷を持つべきです。
- すべての原子が電荷を持っているので、描かれた構造は安定したものではありません(ルイス構造は電荷の少ない安定したものであるべきです)。
- さて、ローンペアやペアを結合に変換することで、電荷を最小限にするようにしましょう。
- ここで、電荷を最小限にするために、ローンペアを結合に変えてみましょう。例えば、酸素原子のローンペアをC-O結合に変えます。
- これで、炭素原子と1つの酸素原子の間に二重結合ができました(1つのC=O結合)。
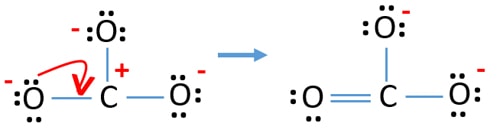
新しい構造では、原子の電荷は以前の構造よりも減少します。
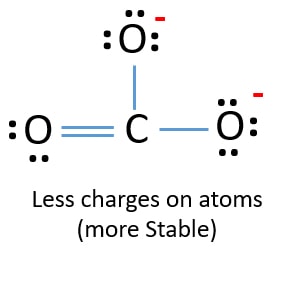
新しい構造では、前の構造よりも原子の電荷が減り、1つの酸素原子と炭素原子には電荷がありません。 また、2つの酸素原子だけが-1の負電荷を持っています。 これで、CO32-の構造は、以前の構造よりも安定していることがわかりました。 この構造は、以前の構造よりも安定しているので、CO32-イオンのルイス構造になる可能性が高くなります。
CO32-(炭酸)イオンのルイス構造
質問
化学の質問をして答えを見つけよう
炭酸ルイス構造と重炭酸ルイス構造
炭酸イオンの中には2つの酸素原子があります。 炭酸イオンには2つの酸素原子があり、それぞれに-1の電荷があります。
炭酸イオンには2つの酸素原子があり、それぞれに-1の電荷があります。
関連するチュートリアル