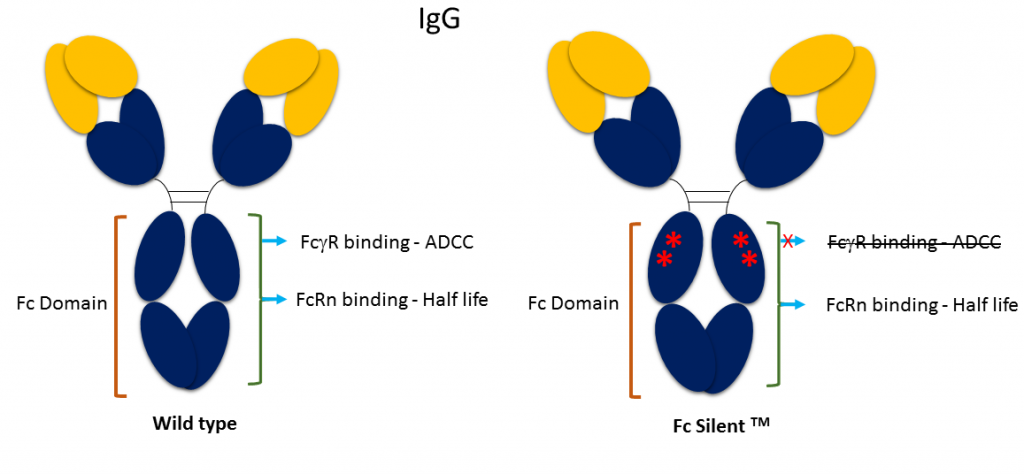
 Fc Silent™は、絶対抗体が研究およびアッセイ開発のために開発した、遺伝子操作によるFcドメインです。
Fc Silent™は、絶対抗体が研究およびアッセイ開発のために開発した、遺伝子操作によるFcドメインです。
当社のFc Silent™抗体は、研究者がin vivoでエフェクター機能を除去し、染色法における非特異的バックグラウンドを低減することを可能にします。 生体内では、Fcドメインに関連する長い血漿中半減期(t1/2)の恩恵を受けることができ、野生型Fcドメインに関連する細胞溶解免疫エフェクターメカニズムはありません。 In vitroでは、Fc受容体の結合に起因する非特異的なバックグラウンドシグナルを低減するため、フローサイトメトリーや免疫組織化学(IHC)のアプリケーションに使用することができます。
すべてのAbsolute Antibodyの抗体および融合タンパク質は、Fc Silent™ドメインを備えています。 当社の試薬カタログには、ヒト、マウス、ウサギ、ラット、ハムスターなどの種特異的なFc Silent™ドメインが掲載されており、在庫があってすぐに購入できます。
Fcレセプターのエフェクター機能への影響やFcエンジニアリングの取り組みについての詳細は、研究者向けの無料オンラインリファレンスリソースであるAntibody Resourceをご覧ください。
Fc Silent™ Binding Data
マウスIgG2aおよびラットIgG2bアイソタイプは、試験抗体の特異性にかかわらず、Fc受容体に強く結合することが知られています。 アイソタイプコントロールは、研究者が特異的なバックグラウンドシグナルと非特異的なバックグラウンドシグナルを区別するために採用されます。 図1では、ネズミのマクロファージがラットIgG2bアイソタイプコントロールによって、抗F4/80とほぼ同様に強く標識される様子を示しています。 Fc Silent™抗体に切り替えると、二次抗体のみのコントロールと区別がつかないほどのバックグラウンド染色が得られ、信頼性の高いデータが得られます。
図2では、表面プラズモン共鳴(SPR)と直接競合阻害ELISAを用いて、Fc Silent™フォーマットがネズミやヒトのFc受容体と相互作用しないことを示しています。
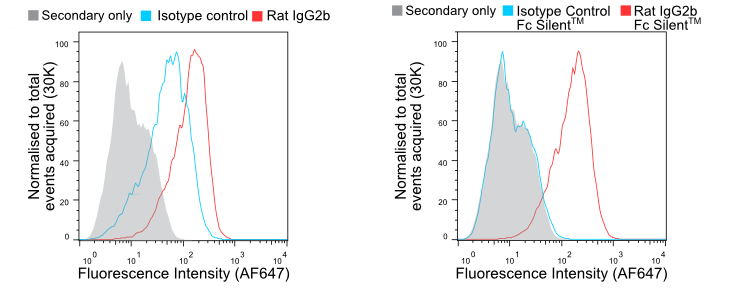
Figure 1. 野生型(A)およびFc Silent™(B)の抗F4/80(Ab00106-8.1およびAb00106-8.4)抗体とアイソタイプコントロール抗体で染色したBMDMを、蛍光結合したヤギ抗ラット二次抗体で染色したフローサイトメトリー。 Fc Silent™を使用することで、FcγRによる非特異的な染色がなくなり、よりクリーンで正確なデータが得られます。 詳細はこちら
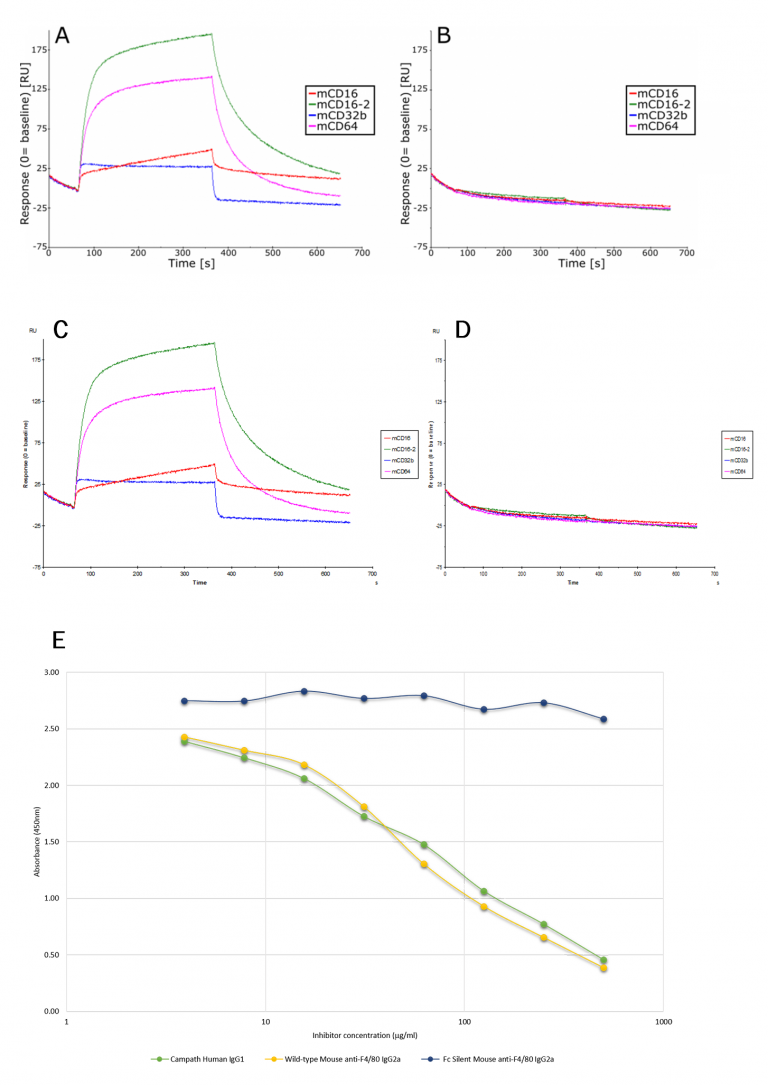
図2AおよびB. マウス野生型およびFc Silent™抗F4/80 IgG2aモノクローナル抗体(Ab00106-2.0およびAb00106-2.3)の結合を示すセンソグラム。0およびAb00106-2.3)と、固定化されたマウス低親和性および高親和性Fcγ受容体(CD16、CD16-2、CD32、CD64)との結合を示すセンソグラムである。
図2CおよびD. ラット野生型およびFc Silent™抗F4/80モノクローナル抗体(それぞれAb00106-8.1およびAb00106-8.4)と、固定化されたマウス低・高親和性Fcγ受容体(CD16, CD16-2, CD32, CD64)との結合を示すセンソグラム。 Biacore SPRによる結合解析の結果、Fc Silent™抗体はマウスFc受容体と相互作用する能力を失っていることがわかりました。
図2E. 直接競合阻害ELISA。 2µg/ml/wellのヒトリコンビナントFcγR1受容体(rCD64)を96ウェルプレートに吸収させた。 40µg/mlのビオチン化Alemtuzumab(Campath)を、未標識の連続希釈マウス野生型またはFc Silent™抗F4/80 IgG2aモノクローナル抗体(それぞれAb00106-2.0またはAb00106-2.3)またはAlemtuzumab(Campath;ポジティブコントロール)とプレミックスした。 このデータは、Fc Silent™抗体であるAb00106-2.3がヒトFc受容体に結合しないことを明確に示しています
。