XeF2とは、二フッ化キセノンという化合物の略語です。 強力なフッ素化剤であると同時に、酸化剤でもあります。 XeF2以外にも、XeF4(四フッ化キセノン)やXeF6(六フッ化キセノン)などのキセノン化合物があります。 これらの化合物のうち、最も安定しているのがXeF2です。 XeF2は白色の結晶性固体で、電気化学的な手順や実験室でフッ素化合物を生成する目的で使用されます。
この化合物の化学的性質や分子構造を理解するには、ルイス構造、混成、極性を知ることが不可欠です。
内容
Xef2のルイス構造
与えられた化学物質のルイス構造は、すべての物理的特性と化学的特性を知る上で非常に重要です。 これは、結合を形成するために参加しているすべての電子を絵で表したものです。 この構造は、化合物の分子の電荷を理解するのに役立ちます。
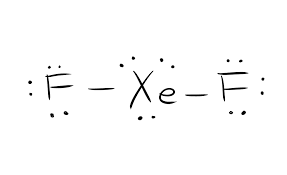
結合形成に参加する電子は、結合対電子と呼ばれます。 また、結合形成に参加しないものをローンペア電子と呼びます。 電子の種類を区別するために、結合対電子と孤立対電子の両方を異なる形で表現しています。
ルイス構造は、オクテットルールに基づいている。 このルールは、すべての分子が安定しているためには、原子の外殻に8個の電子を持たなければならないというものです。 このルールは、すべての分子が安定しているためには、原子の外殻に8個の電子を持っていなければならないというものです。
つまり、このXeF2という化合物は、キセノンが1分子、フッ素が2分子あります。
この化合物XeF2では、キセノンの分子が1個、フッ素の分子が2個あり、キセノンの分子は8個、フッ素の分子は7個の価電子を持っています。
全価電子数=キセノンの価電子数+フッ素の価電子数
=8+ 7*2
=8+14
=22
XeF2の全価電子数=22。
Xef2のハイブリット化

ある分子のハイブリット化は、その分子のジオメトリを理解するために不可欠です。 結合形成の際、エネルギーレベルの異なる2つ以上の軌道が結合してハイブリッド軌道を作ります。 XeF2では、キセノンの外殻には8個の電子があり、そのうち2個の電子が結合形成に参加します。
キセノンの基底状態では、8個の電子がs2 p6の軌道に配置されています。
キセノンの基底状態では、8個の電子がs2 p6軌道に配置されています。 キセノンの電子の配列はs2 p5 d1に変化し、2つの不対電子が存在する。 したがって、中心原子Xeの混成はsp3dとなる。
Xef2の分子構造

一般的に、ルイス構造は任意の化学物質の分子構造を理解するのに役立ちます。 しかし、キセノンは簡単には結合を形成しないため、この化合物は例外的なケースです。 二フッ化キセノンの分子構造は、VSEPR理論を知ることで理解できます。 この理論は、中心となる原子の立体数と化合物の価電子に基づいています。 VSEPRとは、Valence Shell Electron Pair repulsion theory(価電子対の反発理論)の略です。
ここで、中心のキセノン原子の立体数は5です。 しかし、このXeF2では、2つのフッ素原子としか結合していません。 キセノンの場合、8つの電子のうち2つの電子がフッ素原子と結合します。 この6つの電子が非結合電子となります。 この3つの孤立電子ペアは、結合した電子ペアの赤道上に配置されて広がっています。
分子の形は、混成のとおり三角錐になるはずですが、そうではありません。
結合角
二フッ化キセノン分子の分子形状がわかったところで、結合角を簡単に理解することができます。 2組の結合電子と3組の孤立電子があります。 ローンペアは、結合ペアの赤道上にあります。 中心原子と結合している2つのペアの結合角は180度であり、XeF2の分子形状は直線的である。
Xef2の極性
![]()
任意の分子の極性は、その化合物の分子形状と混成に依存します。 XeF2分子では、2つのフッ素原子が外側に対称的に配置され、中央の原子であるキセノンが中央に配置されています。 価電子が対称的に配置されているため、この化合物には正味の双極子モーメントがありません。
結論
この記事を要約すると、XeF2は22個の価電子を持ち、そのうち3つの孤立電子対があります。 その混成はsp3dです。 VSEPR理論によると、分子の形状は直線的である。 F-Xe-Fの結合角は180度である。 中心原子の両側にフッ素分子が存在するため、双極子モーメントがなく、したがって極性もない。 XeF2は、結合している電子のペアが対称的に配置されているため、無極性である。