US Pharm. 2017;42(12):HS2-HS6.
ABSTRACT: 下痢は、カルチノイド腫瘍に続発するカルチノイド症候群を患っている患者において、しばしば明らかになる症状である。 この負担の大きい下痢の病因は、神経内分泌細胞からのセロトニンの分泌過多であると考えられている。 診断は、臨床症状と2つのバイオマーカー、5-ヒドロキシインドール酢酸(尿中)とクロモグラニンA(血清中)に基づいて行われます。 合成ソマトスタチンアナログ(SSA)は、長年にわたり治療の柱となっており、現在も使用されています。 Telotristatは、SSA単独では効果が得られないカルチノイド症候群の下痢患者に対して、SSAとの併用が適応となる初めての経口薬です。
神経内分泌腫瘍(NET)は、ゆっくりと成長する多種多様な腫瘍を包含しています。
神経内分泌腫瘍(NET)は、成長の遅い様々な腫瘍を含んでおり、米国での発生率は10万人あたり2〜5人で、おそらくスクリーニング技術の向上により増加傾向にあります1。 2,3
カルチノイド腫瘍とカルチノイド症候群
カルチノイド腫瘍は、主に消化管や気管支に存在する腸クロム細胞から発生するNETです。 これらの細胞は、セロトニン、ノルエピネフリン、ドーパミン、ヒスタミン、ブラジキニン、プロスタグランジン、サブスタンスPなど、多くの生理活性物質の産生、貯蔵、分泌に関与しており、カルチノイド腫瘍から分泌されるホルモンに起因する様々な症状を総称するカルチノイド症候群の発症につながる可能性があります1-4。
分化したカルチノイドは、多数のソマトスタチン受容体(SSTR)を発現しています1。 カルチノイド腫瘍では、セロトニンが過剰に分泌され、内因性のトリプトファンが枯渇する。 正常な細胞では、トリプトファンの1%しかセロトニンに変換されないが、カルチノイド腫瘍細胞では、トリプトファンが枯渇するまでセロトニンを生成する3。 トリプトファンはナイアシンの前駆体であり、ナイアシンはニコチンアミドおよびニコチンアミドアデニンジヌクレオチド/ニコチンアミドアデニンジヌクレオチドリン酸の必須成分であるとともに、タンパク質合成にも関与している。 カルチノイド症候群を長期間コントロールできない患者は、ペラグラ、心臓弁膜症、静脈毛細血管拡張症、および/または気管支痙攣を発症する可能性があります。2 GIカルチノイド腫瘍の患者のうち、カルチノイド症候群を発症するのは10%未満であり、発症した患者のほとんどは肝転移を有しています。
カルチノイド症候群の下痢
カルチノイド症候群の患者の80%に下痢が見られます6。カルチノイド症候群の下痢の患者は、爆発的な水様性の緩い便を1日に何度も経験しますが、これは患者にとって負担であり、医療従事者にとっても困難です。 あるコホート研究によると、カルチノイド症候群の下痢患者は、そうでない患者に比べて、医療費が1.5倍、入院リスクが2倍になることが分かっています7。カルチノイド症候群の下痢の病態生理には、過剰なセロトニンの存在が関与しています。セロトニンは、大腸粘液の分泌を刺激し、蠕動運動を増加させ、消化管での吸収を阻害し、これらすべてが下痢につながります3,4,6。 健康な患者と比較して、カルチノイド症候群の下痢患者では、近位結腸通過時間が最大で6倍、小腸通過時間が2倍速くなる可能性があります6
危険因子
NETは、散発的に、または遺伝的に素因のある人に発症すると考えられています3。 第一度近親者がNETに罹患している場合、NETを発症する確率は、男性で10万人あたり12.5人、女性で10万人あたり15.7人とされている7。 カルチノイド症候群の下痢患者36人を対象としたレトロスペクティブレビューでは、その他の関連疾患として、萎縮性胃炎(67%)、悪性貧血(58%)、甲状腺機能低下症(39%)、糖尿病(19%)、副腎皮質機能不全(6%)、副甲状腺機能亢進症(6%)などが報告されています8。8 NIH-AARP Diet and Health Studyに登録した494,000人の被験者を8年間追跡調査した結果、飽和脂肪の摂取はカルチノイド腫瘍の発症リスクの増加と関連していることがわかった9。 肉および脂肪の摂取量は、食事頻度調査から推定した。 小腸のカルチノイド腫瘍のリスクは、飽和脂肪の摂取量が多い場合と少ない場合とで関連していた(ハザード比3.18、95%CI、1.62-6.25)。9 カルチノイド症候群の下痢を発症した場合、食生活やストレスが症状に影響を及ぼす可能性がある。 患者は、チロシンを含む食品(熟成したチーズ、発酵した肉や魚、漬け物、豆腐、チョコレート)、アルコール、カテコールアミンの増加(運動、労作)などの促進要因を避ける必要があります。1,2
診断
カルチノイド症候群下痢症の診断は、下痢や顔面紅潮などの症状に加え、生検、腹部・骨盤の多相CT、MRI、バイオマーカーなどによるカルチノイド腫瘍の客観的所見に基づいて行われます10。 10,11 セロトニンはモノアミンオキシダーゼによって5-HIAAに代謝され、CgAはセロトニンを貯蔵する小胞の壁から放出されます。 正常な尿中の5-HIAA濃度は3~15mg/24時間であり、この濃度の上昇はカルチノイド腫瘍に対する特異性が100%、感度が73%である11。血清CgA濃度は腫瘍の大きさと相関する傾向があるが、症状とは相関しない。 11 患者は採尿の48時間前からセロトニンを多く含む食品を避けるべきである。 尿中の5-HIAA濃度はレボドパによって誤って低下することがあり、血清CgA濃度はプロトンポンプ阻害剤、腎不全、炎症状態によって誤って上昇することがある10-13。
治療
カルチノイド症候群の下痢に対する治療法は、症状の改善とバイオマーカーの正常化によって証明される疾患自体の改善に重点が置かれています11。 ソマトスタチンは、消化管運動、膵臓および腸管ホルモンの分泌、胆汁および大腸液の分泌など、いくつかの消化管機能に影響を与えます13。ソマトスタチンが受容体に結合すると、生物学的メディエーターの分泌が抑制され、尿中の5-HIAAの減少に見られるように、セロトニンを低下させることで、潮紅や下痢が劇的に改善します13。
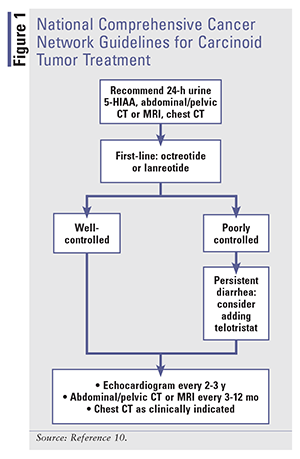
Somatostatin Analogues: 16,17 短時間作用型(SA)オクトレオチドは、カルチノイド腫瘍に関連する症状のコントロールのために承認された最初のSSAである16,18。 SA製剤とLA製剤を比較した研究では、症状のコントロールという点で、60%から72%の奏効率で同等の効果が示されています18
ランレオチドは、徐放性製剤(Somatuline Depot)として、4週間ごとに深部SC注射で投与することができます17,18。 SA octreotideとLA lanreotideの症状緩和効果は同等である16。カルチノイド症候群に伴う症状のコントロールにSA octreotide SCを使用することを目的に、lanreotide 120mg SC(n=59)またはプラセボ(n=56)を4週間ごとに16週間投与する第III相臨床試験が実施された19。 オクトレオチドをレスキュー薬として使用した日数の割合は、ランレオチド患者(33.7%、95%CI、25~42.4%)がプラセボ患者(48.5%、95%CI、39.6~57.4%、P = 0.016)よりも有意に低かった
Pasireotide(Signifor)は、オクトレオチドやランレオチドよりも高い親和性でSSTR1およびSSTR5に結合します16。 第2相臨床試験では、オクトレオチドに反応しなくなった進行性NETおよびカルチノイド症候群の患者に有効性が示された20。 先端巨大症とクッシング症候群に対してのみFDA承認されているパシレオチド長時間作用型放出剤(LAR)は、2015年に行われた第3相試験において、高用量のオクトレオチドLARと比較してカルチノイド症候群の症状をコントロールする上で同等の効果を示し、SSAに抵抗性のある患者のprogression-free-survivalを改善する結果となりました21,22
症状コントロールが目的の場合、治療はSAオクトレオチドから始まります。 LA製剤は、定常状態のレベルに達するまでに3週間ほどかかることがあるため、症状コントロールはSAオクトレオチドで管理することができます15,18。投与量は低用量で開始し(1日100~600mcgを2~4回に分けて投与)、症状コントロールに必要な最低有効量まで漸増します。 LAオクトレオチドは20mgを4週間ごとにIMで投与を開始し、SAオクトレオチドは少なくとも2週間併用する。 投与量、有害事象、潜在的な薬物-薬物相互作用については、表1を参照してください。
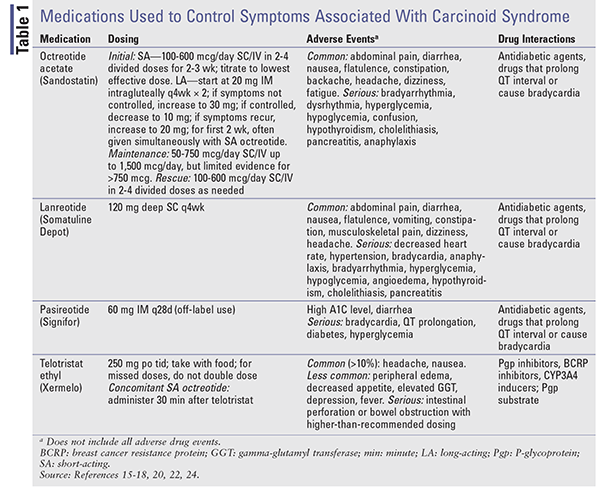
テロトリスタットエチル。 テロトリスタットのプロドラッグであるテロトリスタットエチル(Xermelo)は、トリプトファン水酸化酵素を阻害することで、末梢のセロトニンを減少させます。 カルチノイド症候群の下痢の治療薬として、SSA療法単独では効果が不十分な患者のSSA療法との併用がFDAに承認されています23,24。 第3相前向き無作為化試験では、安定用量のSSAにもかかわらず1日4回以上の排便がある患者135名に、テロトリスタット250mgを1日3回、テロトリスタット500mgを1日3回、またはプラセボを12週間投与しました25。 テロトリスタットは高価であり、250mgの錠剤84錠の平均卸価格は6,196.80ドルであった23
他の薬剤。 カルチノイド症候群の下痢はSSAで治療し、症状が抑えられない場合はテロトリスタットを追加します。 また、基礎疾患であるNETを治療し、腫瘍の活動を低下させる化学療法剤が奏功すれば、カルチノイド症候群の症状が緩和される可能性がある。 これらの化学療法剤を検討することは本稿の範囲外である。 オクトレオチドまたはランレオチドの使用後に疾患が進行した場合、NCCNは切除不能および/または転移性のGI管のNETに対して、エベロリムス、インターフェロンα-2b、または細胞毒性化学療法剤である5-フルオロウラシル、カペシタビン、ダカルバジン、オキサリプラチン、ストレプトゾシン、またはテモゾロミドの使用を推奨している10。
結論
NETの一種であるカルチノイド腫瘍の発生率は増加しています。 カルチノイド症候群の患者の多くは、発症時に肝転移があることが多いのですが、NET発症の危険因子や、どの患者がカルチノイド症候群を発症するかを特定できる因子は知られていません。 カルチノイド症候群は、カルチノイド腫瘍から放出される様々なホルモンを介した一連の症状を表します。 カルチノイド腫瘍を有するすべての患者がカルチノイド症候群を発症するわけではありません。 カルチノイド症候群の下痢は爆発的で、1日に数回発生することもあります。 カルチノイド腫瘍に続発する下痢の症状緩和にはSSA療法が主流ですが、SSA療法に加えられたテロトリスタットのような新しい治療法は、症状が耐えられない患者さんに選択肢を提供しています。
1. Cives M, Soares HP, Strosberg J. Will clinical heterogeneity of neuroendocrine tumors impact their management in the future? Lessons from recent trials. Curr Opin Oncol. 2016;28:359-366.
2.Robertson RG, Geiger WJ, Davis NB. カルチノイド腫瘍。 Am Fam Physician. 2006;74:429-434.
3.Lips CJ, Lentjes EG, Höppener JW. カルチノイド腫瘍とカルチノイド症候群のスペクトル。 Ann Clin Biochem. 2003;40:612-627.
4.Bertrand PP, Bertrand RL. 消化管におけるセロトニンの放出と取込み。 Auton Neurosci. 2010;153:47-57.
5. Yao JC, Hassan M, Phan A, et al. One hundred years after “carcinoid”: Epidemiology of and Prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008;26:3063-3072.
6. von der Ohe MR, Camilleri M, Kvols LK, Thomforde GM. カルチノイド症候群で下痢をしている患者の小腸と大腸の運動機能障害。 N Engl J Med. カルチノイド腫瘍の家族性発生と他の悪性新生物との関連性。 Cancer Epidemiol Biomarkers Prev. 1999年、8:715-719.
8.Gough DB, Thompson GB, Crotty TB, et al. Diverse clinical and pathologic features of gastric carcinoid and the relevance of hypergastrinemia.
9. Cross A, Leitzmann MF, Subar AF, et al. A prospective study of meat and fat intake in relation to small intestinal cancer.
10. National Comprehensive Cancer Network. 腫瘍学におけるNCCN臨床実践ガイドライン(NCCNガイドライン®):神経内分泌腫瘍。 バージョン3.2017. www.nccn.org/professionals/physician_gls/PDF/neuroendocrine.pdf. Accessed October 11, 2017.
11. Maroun J, Kocha W, Kvols L, et al.カルチノイド腫瘍の診断と管理のためのガイドライン。 第1部:消化管。 カナダ全国カルチノイド専門家グループの声明。 Curr Oncol. 2006;13:67-76.
12. エリックソンB、オーベリK、ストリッツバーグM、神経内分泌腫瘍の腫瘍マーカー。 Digestion. 2000;62(suppl 1):33-38.
13. van der Lely AJ, de Herder WW. このようにして得られた結果が、「カルチノイド症候群」です。 Arq Bras Endocrinol Metabol. 2005;49:850-860.
14. Cives M, Strosberg J. Treatment strategies for metastatic neuroendocrine tumors of the gastrointestinal tract(消化管の転移性神経内分泌腫瘍に対する治療戦略)。 Curr Treat Options Oncol. 2017;18:14.
15. Enzler T, Fojo T. 切除不能/転移性神経内分泌腫瘍の治療における長時間作用型ソマトスタチンアナログ。 Semin Oncol. 2017;44:141-156.
16. オクトレオチド。 レキシコンプ・オンライン。 オハイオ州ハドソン:Lexi-Comp, Inc; 2017. http://online.lexi.com。 Accessed October 11, 2017.
17. ランレオチド。 Lexicompオンライン。 オハイオ州ハドソン:Lexi-Comp, Inc; 2017. http://online.lexi.com。 Accessed October 11, 2017.
18. Narayanan S, Kunz PL. 神経内分泌腫瘍の治療におけるソマトスタチンアナログ製剤の役割。 Hematol Oncol Clin N Am. 2016;30:163-177.
19. Vinik AI, Wolin EM, Liyanage N, et al.Evaluation of lanreotide depot/autogel efficacy and safety as a carcinoid syndrome treatment (ELECT): a randomized, double-blind, placebo-controlled trial. Endocr Pract. 2016;22:1068-1080.
20. Kvols LK, Oberg KE, O’Dorisio TM, et al. Pasireotide(SOM230)は、オクトレオチドLARに抵抗性または耐性のある進行性神経内分泌腫瘍患者の治療において、有効性と忍容性を示す:第2相試験の結果。 Endocr Relat Cancer. 2012;19:657-666.
21. このような状況の中で、私たちは、これまでの経験を生かして、より多くの患者さんに、より良い治療を提供していきたいと考えています。 Drug Des Devel Ther. 2015;9:5075-5086.
22. パシレオチド。 Micromedex Solutions. グリーンウッドビレッジ、CO: Truven Health Analytics. www.micromedexsolutions.com. Accessed October 23, 2017.
23. Markham A. Telotristat ethyl: first global approval. Drugs. 2017;77:793-798.
24. テロトリスタット。 レキシコンプ・オンライン。 オハイオ州ハドソン:Lexi-Comp, Inc; 2017. http://online.lexi.com。 Accessed October 11, 2017.
25. Kulke MH, Hörsch D, Caplin ME, et al. Telotristat ethyl, a tryptophan hydroxylase inhibitor for the treatment of carcinoid syndrome(カルチノイド症候群の治療のためのトリプトファン水酸化酵素阻害剤)。 J Clin Oncol. 2017;35:14-23.