|
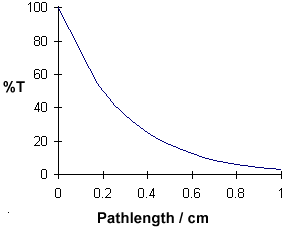
La longueur du chemin / cm
|
0
|
0.2
|
0,4
|
0,6
|
0.8
|
1,0
|
|
|
%T
|
100
|
50
|
25
|
12.5
|
6,25
|
3.125
|
|
|
Absorbance
|
0
|
0.3
|
0,6
|
0,9
|
1,2
|
1.5
|
 |
 |
A = ebc nous indique que l’absorbance dépend de la quantité totale du composé absorbant dans le trajet lumineux à travers la cuvette. Si nous traçons l’absorbance en fonction de la concentration, nous obtenons une droite passant par l’origine (0,0).
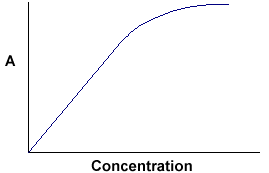 |
Notez que la loi n’est pas respectée à des concentrations élevées. Cette déviation de la loi n’est pas traitée ici. |
La relation linéaire entre la concentration et l’absorbance est à la fois simple et directe, c’est pourquoi nous préférons exprimer la loi de Beer-Lambert en utilisant l’absorbance comme mesure de l’absorption plutôt que le %T.
Question : Quelle est la signification de l’absorbance molaire, e ?
Réponse : Pour commencer, nous allons réarranger l’équation A = ebc :
e = A / bc
En mots, cette relation peut être énoncée comme « e est une mesure de la quantité de lumière absorbée par unité de concentration ».
L’absorbance molaire est une constante pour une substance particulière, donc si la concentration de la solution est divisée par deux, l’absorbance l’est aussi, ce qui est exactement ce à quoi vous vous attendez.
Prenons un composé avec une valeur très élevée d’absorbance molaire, disons 100 000 L mol-1 cm-1, qui est en solution dans une cuvette de 1 cm de longueur de parcours et donne une absorbance de 1.
e = 1 / 1 ‘ c
Donc, c = 1 / 100 000 = 1 ‘ 10-5 mol L-1
Prenons maintenant un composé avec une très faible valeur de e, disons 20 L mol-1 cm-1 qui est en solution dans une cuvette de 1 cm de pathlength et donne une absorbance de 1.
e = 1 / 1 ‘ c
Donc, c = 1 / 20 = 0.05 mol L-1
La réponse est maintenant évidente – un composé à forte absorbance molaire est très efficace pour absorber la lumière (de la longueur d’onde appropriée), et donc de faibles concentrations d’un composé à forte absorbance molaire peuvent être facilement détectées.
Question : Quelle est l’absorbance molaire des ions Cu2+ dans une solution aqueuse de CuSO4 ? Elle est soit de 20 soit de 100 000 L mol-1 cm-1
Réponse : Je suppose que vous pensez que la valeur la plus élevée est correcte, car les solutions de sulfate de cuivre que vous avez vues sont généralement d’un beau bleu vif. Cependant, la valeur réelle de l’absorbance molaire est de 20 L mol-1 cm-1 ! La couleur bleu vif est observée parce que la concentration de la solution est très élevée.
Le b-carotène est un composé organique présent dans les légumes et responsable de la couleur des carottes. On le trouve à des concentrations excessivement faibles. Vous ne serez peut-être pas surpris d’apprendre que l’absorbance molaire du b-carotène est de 100 000 L mol-1 cm-1 !
Revoyez votre apprentissage
Vous devriez maintenant avoir une bonne compréhension de la loi de Beer-Lambert ; des différentes façons dont nous pouvons rendre compte de l’absorption, et comment elles sont liées les unes aux autres. Vous devriez également comprendre l’importance de l’absorbance molaire, et comment elle affecte la limite de détection d’un composé particulier.
![]()
.