|
Padlengte / cm
|
0
|
0.2
|
0.4
|
0.6
|
0.8
|
1.0
|
%T
|
100
|
50
|
25
|
12.5
|
6.25
|
3.125
|
Absorbantie
|
0
|
0.3
|
0.6
|
0.9
|
1.2
|
1.5
|
 |
 |
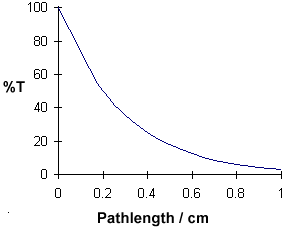
A = ebc vertelt ons dat de extinctie afhangt van de totale hoeveelheid van de absorberende verbinding in het lichtpad door de cuvet. Als we de extinctie uitzetten tegen de concentratie, krijgen we een rechte lijn die door de oorsprong (0,0) gaat.
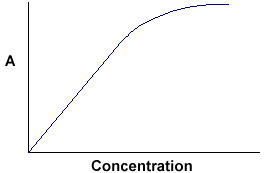 |
Merk op dat de wet niet wordt nageleefd bij hoge concentraties. Deze afwijking van de Wet wordt hier niet behandeld. |
Het lineaire verband tussen concentratie en extinctie is zowel eenvoudig als rechtlijnig, daarom geven we er de voorkeur aan de wet van Beer-Lambert uit te drukken met extinctie als maat voor de extinctie in plaats van %T.
Vraag : Wat is de betekenis van de molaire extinctiecoëfficiënt, e ?
Antwoord : Om te beginnen zullen we de vergelijking A = ebc herschikken :
e = A / bc
In woorden kan deze relatie worden gesteld als “e is een maat voor de hoeveelheid licht die per concentratie-eenheid wordt geabsorbeerd”.
De molaire extinctiecoëfficiënt is een constante voor een bepaalde stof, dus als de concentratie van de oplossing wordt gehalveerd, wordt de extinctiecoëfficiënt ook gehalveerd, wat precies is wat je zou verwachten.
Nemen we een verbinding met een zeer hoge waarde van de molaire extinctiecoëfficiënt, zeg 100.000 L mol-1 cm-1, die zich in een oplossing in een cuvette met een weglengte van 1 cm bevindt en een extinctiecoëfficiënt van 1 geeft.
e = 1 / 1 ´ c
Daarom is c = 1 / 100.000 = 1 ´ 10-5 mol L-1
Nemen we nu een verbinding met een zeer lage waarde van e, zeg 20 L mol-1 cm-1 die in oplossing is in een cuvette met een weglengte van 1 cm en een extinctie geeft van 1.
e = 1 / 1 ´ c
Daarom is c = 1 / 20 = 0.05 mol L-1
Het antwoord is nu duidelijk – een verbinding met een hoge molaire extinctiecoëfficiënt is zeer effectief in het absorberen van licht (van de juiste golflengte), en dus kunnen lage concentraties van een verbinding met een hoge molaire extinctiecoëfficiënt gemakkelijk worden gedetecteerd.
Vraag : Wat is de molaire extinctiecoëfficiënt van Cu2+ ionen in een waterige oplossing van CuSO4 ? Deze is of 20 of 100.000 L mol-1 cm-1
Antwoord : Ik vermoed dat u denkt dat de hogere waarde juist is, omdat kopersulfaatoplossingen die u hebt gezien meestal een mooie helderblauwe kleur hebben. De werkelijke waarde van het molaire absorptievermogen is echter 20 L mol-1 cm-1 ! De helderblauwe kleur wordt gezien omdat de concentratie van de oplossing zeer hoog is.
b-caroteen is een organische verbinding die in groenten wordt aangetroffen en verantwoordelijk is voor de kleur van wortelen. Het wordt in zeer lage concentraties aangetroffen. Het zal u niet verbazen dat de molaire extinctiecoëfficiënt van b-caroteen 100.000 L mol-1 cm-1 bedraagt !
Bekijk wat je geleerd hebt
Je moet nu een goed begrip hebben van de wet van Beer-Lambert; de verschillende manieren waarop we absorptie kunnen aangeven, en hoe ze zich tot elkaar verhouden. Je zou ook het belang van de molaire absorptie moeten begrijpen, en hoe dit de aantoonbaarheidsgrens van een bepaalde verbinding beïnvloedt.
![]()