L’anticorps (Ab) également connu sous le nom d’immunoglobuline (Ig) est la grande protéine en forme de Y produite par le système immunitaire de l’organisme lorsqu’il détecte des substances nocives, appelées antigènes comme les bactéries et les virus. La production d’anticorps est une fonction majeure du système immunitaire et est assurée par un type de globule blanc appelé cellule B (lymphocyte B), des cellules B différenciées appelées plasmocytes. Les anticorps produits se lient à des antigènes spécifiques exprimés dans des facteurs externes et des cellules cancéreuses.

Structure de l’anticorps
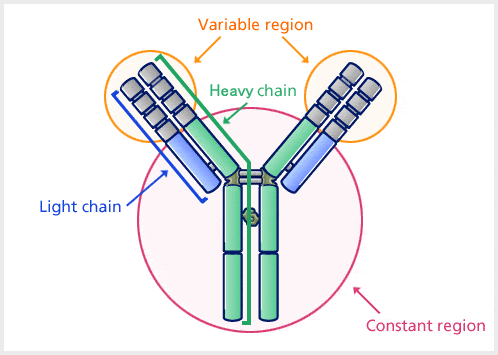
Les anticorps sont des protéines plasmatiques globulaires lourdes (~150 kDa). La structure de base de tous les anticorps est la même.
Source : Kyowa Hakko Kirin Co, Ltd
Il existe quatre chaînes polypeptidiques : deux chaînes lourdes identiques et deux chaînes légères identiques reliées par des liaisons disulfures. La chaîne légère (L) est constituée de polypeptides d’environ 22 000 Da et la chaîne lourde (H) est constituée de polypeptides plus gros d’environ 50 000 Da ou plus. Il existe cinq types de chaîne lourde d’Ig (chez les mammifères) désignés par les lettres grecques : α, δ, ε, γ et μ. Il existe deux types de chaîne légère d’Ig (chez le mammifère), qui sont appelés lambda (λ) et kappa (κ).
Un anticorps est composé d’une région variable et d’une région constante, et la région qui change en diverses structures selon les différences d’antigènes est appelée la région variable, et la région qui a une structure constante est appelée la région constante.
Source : Sino Biological Inc.
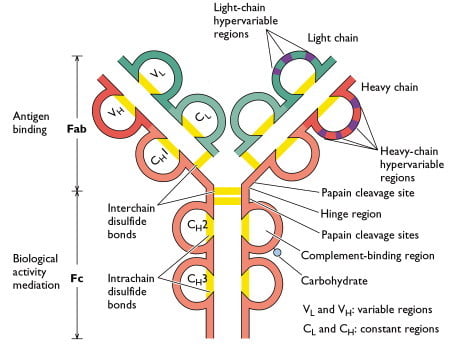
Chaque chaîne lourde et légère d’une molécule d’immunoglobuline contient une région variable (V) amino-terminale qui comprend 100 à 110 acides aminés et diffère d’un anticorps à l’autre. Le reste de chaque chaîne de la molécule – la région constante (C) – présente une variation limitée qui définit les deux sous-types de chaînes légères et les cinq sous-classes de chaînes lourdes. Certaines chaînes lourdes (α, δ, γ) contiennent également une région charnière riche en proline. Les parties amino-terminales, correspondant aux régions V, se lient à l’antigène ; les fonctions effectrices sont médiées par les domaines carboxy-terminaux. Les chaînes lourdes ε et μ, qui sont dépourvues de région charnière, contiennent un domaine supplémentaire au milieu de la molécule. CHO désigne un groupe glucidique lié à la chaîne lourde.
Classes/types d’anticorps
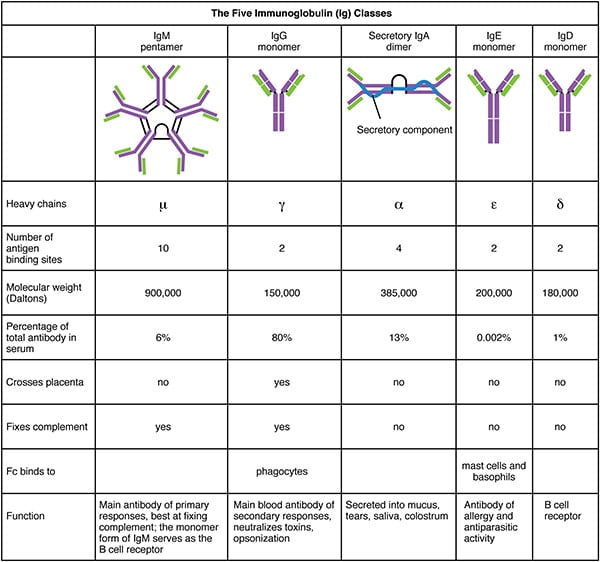
Le sérum contenant des anticorps spécifiques d’un antigène est appelé antisérum. Les 5 types – IgG, IgM, IgA, IgD, IgE – (isotypes) sont classés selon le type de région constante de la chaîne lourde, et sont distribués et fonctionnent différemment dans l’organisme.
Fonctions des anticorps
- Les IgG assurent une protection à long terme car elles persistent des mois et des années après la présence de l’antigène qui a déclenché leur production.
- Les IgG protègent contre les bactéries, les virus, neutralisent les toxines bactériennes, déclenchent des systèmes de protéines complémentaires et se lient aux antigènes pour renforcer l’efficacité de la phagocytose.
- La fonction principale des IgA est de se lier aux antigènes des microbes avant qu’ils n’envahissent les tissus. Elle agrège les antigènes et les maintient dans les sécrétions de sorte que lorsque la sécrétion est expulsée, l’antigène l’est aussi.
- Les IgA sont également la première défense des surfaces muqueuses telles que les intestins, le nez et les poumons.
- L’IgM est impliquée dans les antigènes du groupe sanguin ABO à la surface des GR.
- Les IgM améliorent les ingestions de cellules par phagocytose.
- Les IgE se lient aux mastocytes et aux basophiles qui participent à la réponse immunitaire.
- Certains scientifiques pensent que le but des IgE est de stopper les parasites.
- Les IgD sont présentes à la surface des cellules B et jouent un rôle dans l’induction de la production d’anticorps.
.