抗体(Ab)は、免疫グロブリン(Ig)としても知られていますが、バクテリアやウイルスなどの抗原と呼ばれる有害物質を体内の免疫システムが検出した際に産生される大きなY字型のタンパク質です。 抗体の産生は、免疫系の主要な機能であり、B細胞(Bリンパ球)と呼ばれる白血球の一種や、形質細胞と呼ばれる分化したB細胞によって行われます。 産生された抗体は、外的要因やがん細胞などに発現する特定の抗原に結合する。

抗体の構造
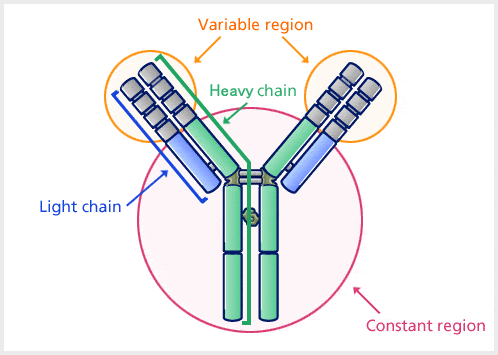
抗体は重い(~150kDa)球状の血漿タンパク質である。
出典:協和発酵キリン株式会社。 協和発酵キリン株式会社
ポリペプチド鎖は、2本の同じ重鎖と2本の同じ軽鎖がジスルフィド結合でつながった4本のポリペプチド鎖があります。 軽鎖(L)は約22,000 Daのポリペプチドからなり、重鎖(H)は約50,000 Da以上の大きなポリペプチドからなります。 哺乳類のIg重鎖には、ギリシャ文字でα、δ、ε、γ、μの5種類がある。
抗体は可変領域と定常領域からなり、抗原の違いによって様々な構造に変化する領域を可変領域、一定の構造を持つ領域を定常領域と呼んでいます。
Source:
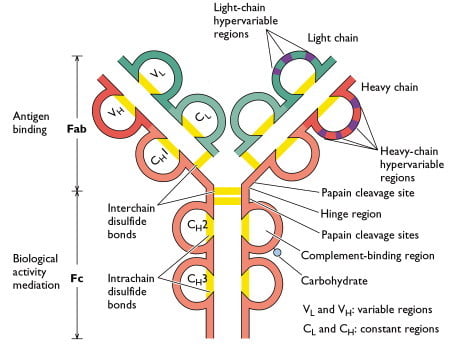
免疫グロブリン分子の重鎖と軽鎖のそれぞれには、アミノ末端に100~110個のアミノ酸からなる可変(V)領域があり、抗体ごとに異なります。 また、分子内の各鎖の残りの部分である定数(C)領域は、2つの軽鎖のサブタイプと5つの重鎖のサブクラスを定義する限られたバリエーションを示している。 一部の重鎖(α、δ、γ)には、プロリンに富んだヒンジ領域が存在する。 V領域に相当するアミノ末端部分は抗原に結合し、エフェクター機能はカルボキシ末端ドメインが担っている。 εおよびμ重鎖は、ヒンジ領域を持たないが、分子の中央部に追加のドメインを持つ。 CHOは重鎖に結合している炭水化物グループを示す。
抗体の種類
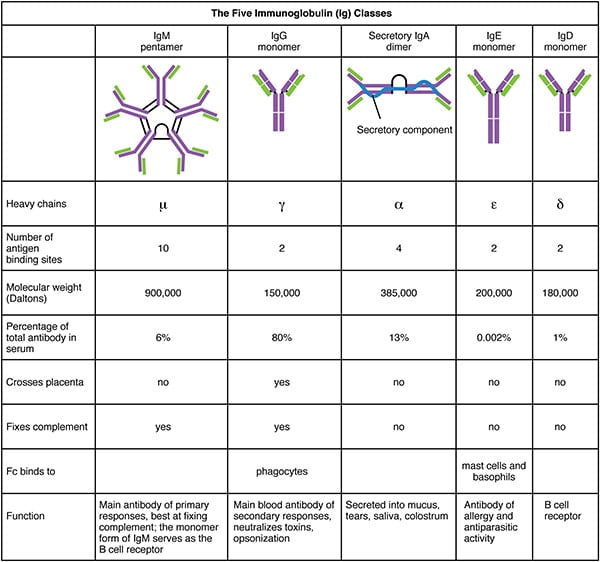
抗原特異的な抗体を含む血清を抗血清という。 重鎖の定数領域の種類によってIgG、IgM、IgA、IgD、IgEの5種類(アイソタイプ)に分類され、体内での分布や機能が異なります。
Functions of Antibody
- IgGは、その産生のきっかけとなった抗原が存在した後、数ヶ月から数年にわたって持続するため、長期的な保護を提供します。
- IgGは細菌やウイルスから身を守り、細菌の毒素を中和し、補完的なタンパク質システムを誘発し、抗原を結合して食作用の効果を高めます
- IgAの主な機能は、微生物が組織に侵入する前に抗原を結合することです。
- IgAの主な機能は、微生物が組織に侵入する前に抗原を結合させることです。
- IgAは抗原を凝集させて分泌物の中に保持し、分泌物が排出されるときに抗原も排出されます。
- IgMは赤血球の表面にあるABO血液型抗原に関与しています。
- IgMは、食作用によって細胞の摂取を促進する。
- IgEは、免疫反応に関与するマスト細胞や好塩基球に結合する。
- IgEの目的は寄生虫を阻止することであると考える科学者もいる。
- IgDは、B細胞の表面に存在し、抗体産生の誘導に関与する。