Antilichaam (Ab) ook bekend als Immunoglobuline (Ig) is het grote Y-vormige eiwit dat door het immuunsysteem van het lichaam wordt geproduceerd wanneer het schadelijke stoffen detecteert, antigenen genaamd, zoals bacteriën en virussen. De productie van antilichamen is een belangrijke functie van het immuunsysteem en wordt uitgevoerd door een type witte bloedcel dat een B-cel (B-lymfocyt) wordt genoemd, gedifferentieerde B-cellen die plasmacellen worden genoemd. De geproduceerde antilichamen binden zich aan specifieke antigenen die tot uiting komen in externe factoren en kankercellen.

Structuur van antilichaam
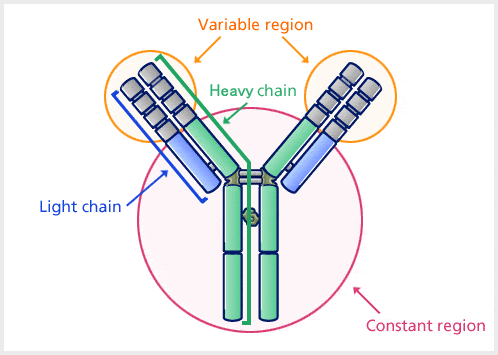
Antilichamen zijn zware (~150 kDa) bolvormige plasma-eiwitten. De basisstructuur van alle antilichamen is hetzelfde.
Bron: Kyowa Hakko Kirin Co, Ltd
Er zijn vier polypeptideketens: twee identieke zware ketens en twee identieke lichte ketens, verbonden door disulfidebindingen. De lichte keten (L) bestaat uit polypeptiden van ongeveer 22.000 Da en de zware keten (H) uit grotere polypeptiden van ongeveer 50.000 Da of meer. Er zijn vijf soorten Ig-zware ketens (bij zoogdieren), aangeduid met de Griekse letters: α, δ, ε, γ en μ. Er zijn twee soorten Ig-lichte ketens (bij zoogdieren), die lambda (λ) en kappa (κ) worden genoemd.
Een antilichaam bestaat uit een variabele regio en een constante regio, waarbij de regio die afhankelijk van verschillen in antigenen van structuur verandert, de variabele regio wordt genoemd, en de regio die een constante structuur heeft, de constante regio wordt genoemd.
Bron: Sino Biological Inc.
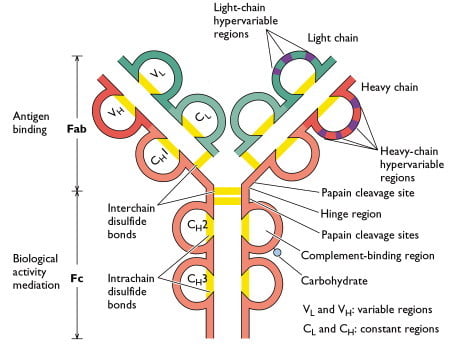
Elke zware en lichte keten in een immunoglobulinemolecuul bevat een amino-terminale variabele (V) regio die bestaat uit 100 tot 110 aminozuren en verschilt van antilichaam tot antilichaam. De rest van elke keten in het molecuul – de constante (C) regio vertoont een beperkte variatie die de twee lichte keten subtypes en de vijf zware ketens subklassen definieert. Sommige zware ketens (α, δ, γ) bevatten ook een proline-rijk scharniergebied. De amino-einddelen, die overeenkomen met de V-regio’s, binden zich aan antigeen; de carboxy-terminale domeinen zorgen voor de effectorfuncties. De ε- en μ-zware ketens, die geen scharniergebied hebben, bevatten een extra domein in het midden van het molecuul. CHO staat voor een koolhydraatgroep die aan de zware keten is gekoppeld.
Klassen/Typen antilichamen
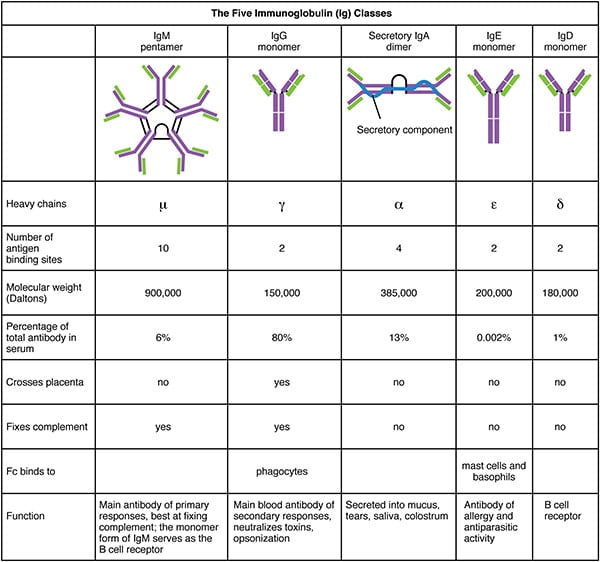
Serum dat antigeenspecifieke antilichamen bevat, wordt antiserum genoemd. De 5 typen – IgG, IgM, IgA, IgD, IgE – (isotypen) zijn ingedeeld volgens het type van de constante regio van de zware keten, en zijn verschillend verdeeld en functioneren verschillend in het lichaam.
Functies van Antilichamen
- IgG biedt bescherming op lange termijn omdat het nog maanden en jaren blijft bestaan na de aanwezigheid van het antigeen dat de aanmaak ervan heeft uitgelokt.
- IgG beschermt tegen bacteriën, virussen, neutraliseert bacteriële toxinen, activeert compliment protein systemen en bindt antigenen om de effectiviteit van fagocytose te vergroten.
- De belangrijkste functie van IgA is het binden van antigenen op microben voordat ze weefsels binnendringen. Het aggregeert de antigenen en houdt ze in de afscheidingen, zodat wanneer de afscheiding wordt uitgestoten, het antigeen ook wordt uitgescheiden.
- IgA zijn ook de eerste verdediging voor mucosale oppervlakken zoals de darmen, neus en longen.
- IgM is betrokken bij de ABO-bloedgroepantigenen op het oppervlak van RBC’s.
- IgM versterken de opname van cellen door fagocytose.
- IgE binden zich aan mestcellen en basofielen die deelnemen aan de immuunrespons.
- Sommige wetenschappers denken dat IgE tot doel heeft parasieten tegen te houden.
- IgD is aanwezig op het oppervlak van B-cellen en speelt een rol bij de inductie van antistofproductie.