|
Weglänge / cm
|
0
|
0.2
|
0,4
|
0,6
|
0.8
|
1.0
|
||
|
%T
|
100
|
50
|
25
|
12.5
|
6,25
|
3.125
|
||
|
Absorption
|
0
|
0.3
|
0,6
|
0,9
|
1,2
|
1.5
|
 |
 |
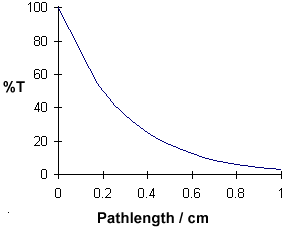
A = ebc sagt uns, dass die Extinktion von der Gesamtmenge der absorbierenden Verbindung im Lichtweg durch die Küvette abhängt. Wenn wir die Absorption gegen die Konzentration auftragen, erhalten wir eine gerade Linie, die durch den Ursprung (0,0) geht.
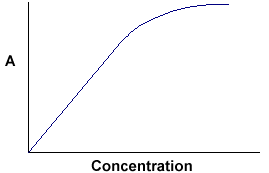 |
Beachten Sie, dass das Gesetz bei hohen Konzentrationen nicht eingehalten wird. Diese Abweichung vom Gesetz wird hier nicht behandelt. |
Die lineare Beziehung zwischen Konzentration und Absorption ist einfach und geradlinig, weshalb wir es vorziehen, das Beer-Lambert-Gesetz mit der Absorption als Maß für die Absorption und nicht mit %T auszudrücken.
Frage : Welche Bedeutung hat das molare Absorptionsvermögen, e?
Antwort : Wir stellen zunächst die Gleichung A = ebc um:
e = A / bc
In Worten lässt sich diese Beziehung folgendermaßen ausdrücken: „e ist ein Maß für die Menge des absorbierten Lichts pro Konzentrationseinheit“.
Das molare Absorptionsvermögen ist eine Konstante für eine bestimmte Substanz, so dass, wenn die Konzentration der Lösung halbiert wird, auch die Absorption sinkt, was genau das ist, was man erwarten würde.
Lassen Sie uns eine Verbindung mit einem sehr hohen Wert des molaren Absorptionsvermögens nehmen, sagen wir 100.000 L mol-1 cm-1, die sich in einer Lösung in einer Küvette mit 1 cm Schichtdicke befindet und eine Absorption von 1 ergibt.
e = 1 / 1 ‚ c
Daher ist c = 1 / 100.000 = 1 ‚ 10-5 mol L-1
Nun nehmen wir eine Verbindung mit einem sehr niedrigen Wert von e, sagen wir 20 L mol-1 cm-1, die in einer Lösung in einer Küvette mit 1 cm Schichtdicke vorliegt und eine Extinktion von 1 ergibt.
e = 1 / 1 ‚ c
Daher ist c = 1 / 20 = 0.05 mol L-1
Die Antwort liegt nun auf der Hand – eine Verbindung mit einem hohen molaren Absorptionsvermögen ist sehr effektiv bei der Absorption von Licht (der entsprechenden Wellenlänge), und daher können niedrige Konzentrationen einer Verbindung mit einem hohen molaren Absorptionsvermögen leicht nachgewiesen werden.
Frage: Wie hoch ist das molare Absorptionsvermögen von Cu2+-Ionen in einer wässrigen Lösung von CuSO4? Sie beträgt entweder 20 oder 100.000 L mol-1 cm-1
Antwort : Ich vermute, dass Sie den höheren Wert für richtig halten, weil Kupfersulfatlösungen, die Sie gesehen haben, meist eine schöne hellblaue Farbe haben. Der tatsächliche Wert der molaren Absorptionsfähigkeit liegt jedoch bei 20 L mol-1 cm-1 ! Die leuchtend blaue Farbe ist zu sehen, weil die Konzentration der Lösung sehr hoch ist.
B-Carotin ist eine organische Verbindung, die in Gemüse vorkommt und für die Farbe von Karotten verantwortlich ist. Sie kommt in äußerst geringen Konzentrationen vor. Es wird Sie vielleicht nicht überraschen zu erfahren, dass das molare Absorptionsvermögen von b-Carotin 100.000 L mol-1 cm-1 beträgt!
Wiederholung des Gelernten
Sie sollten jetzt ein gutes Verständnis des Beer-Lambert-Gesetzes haben; die verschiedenen Arten, wie wir die Absorption angeben können, und wie sie sich zueinander verhalten. Sie sollten auch die Bedeutung des molaren Absorptionsvermögens verstehen und wie dieses die Nachweisgrenze einer bestimmten Verbindung beeinflusst.
![]()