El anticuerpo (Ab), también conocido como inmunoglobulina (Ig), es la gran proteína en forma de Y que produce el sistema inmunitario del cuerpo cuando detecta sustancias nocivas, llamadas antígenos, como bacterias y virus. La producción de anticuerpos es una de las principales funciones del sistema inmunitario y es llevada a cabo por un tipo de glóbulo blanco llamado célula B (linfocito B), células B diferenciadas llamadas células plasmáticas. Los anticuerpos producidos se unen a antígenos específicos expresados en factores externos y células cancerosas.

Estructura del anticuerpo
Los anticuerpos son proteínas plasmáticas globulares pesadas (~150 kDa). La estructura básica de todos los anticuerpos es la misma.
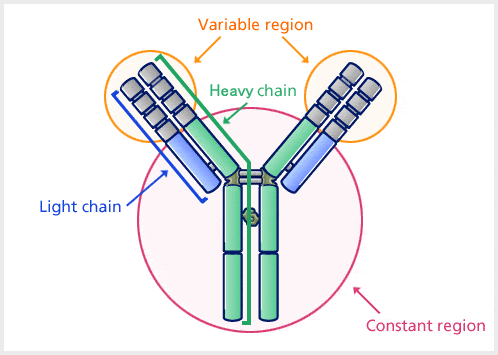
Fuente: Kyowa Hakko Kirin Co., Ltd
Hay cuatro cadenas polipeptídicas: dos cadenas pesadas idénticas y dos cadenas ligeras idénticas conectadas por enlaces disulfuro. La cadena ligera (L) consta de polipéptidos de unos 22.000 Da y la cadena pesada (H) consta de polipéptidos más grandes de unos 50.000 Da o más. Hay cinco tipos de cadena pesada de Ig (en los mamíferos) denotados por las letras griegas: α, δ, ε, γ y μ. Hay dos tipos de cadena ligera de Ig (en mamíferos), que se denominan lambda (λ) y kappa (κ).
Un anticuerpo está formado por una región variable y una región constante, y la región que cambia a varias estructuras dependiendo de las diferencias en los antígenos se llama región variable, y la región que tiene una estructura constante se llama región constante.
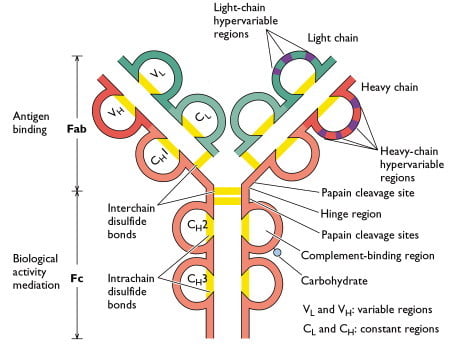
Fuente: Sino Biological Inc.
Cada cadena pesada y ligera de una molécula de inmunoglobulina contiene una región variable aminoterminal (V) que consta de 100 a 110 aminoácidos y difiere de un anticuerpo a otro. El resto de cada cadena de la molécula, la región constante (C), presenta una variación limitada que define los dos subtipos de cadenas ligeras y las cinco subclases de cadenas pesadas. Algunas cadenas pesadas (α, δ, γ) también contienen una región bisagra rica en prolina. Las porciones aminoterminales, correspondientes a las regiones V, se unen al antígeno; las funciones efectoras están mediadas por los dominios carboxi-terminales. Las cadenas pesadas ε y μ, que carecen de región bisagra, contienen un dominio adicional en el centro de la molécula. CHO denota un grupo de carbohidratos unido a la cadena pesada.
Clases/tipos de anticuerpos
El suero que contiene anticuerpos específicos de antígenos se llama antisuero. Los 5 tipos – IgG, IgM, IgA, IgD, IgE – (isotipos) se clasifican según el tipo de región constante de la cadena pesada, y se distribuyen y funcionan de forma diferente en el organismo.
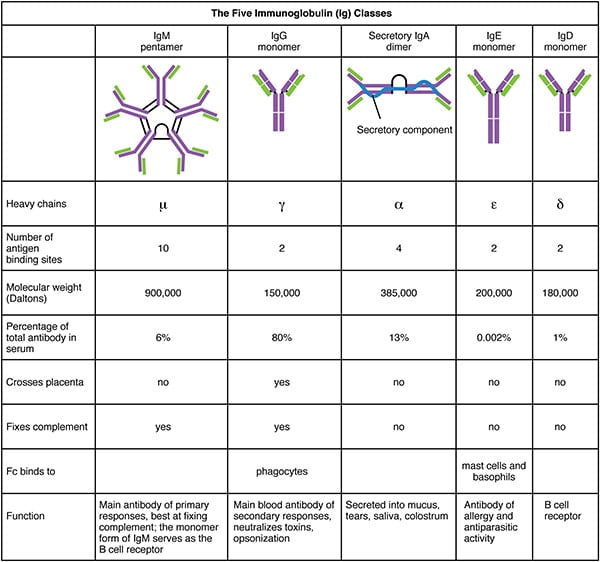
Funciones de los Anticuerpos
- La IgG proporciona una protección a largo plazo porque persiste durante meses y años tras la presencia del antígeno que ha desencadenado su producción.
- Las IgG protegen contra las bacterias, los virus, neutralizan las toxinas bacterianas, activan los sistemas de proteínas de complemento y se unen a los antígenos para aumentar la eficacia de la fagocitosis.
- La función principal de las IgA es unirse a los antígenos de los microbios antes de que invadan los tejidos. Agrega los antígenos y los mantiene en las secreciones, de modo que cuando se expulsa la secreción, también lo hace el antígeno.
- Las IgA también son la primera defensa de las superficies de las mucosas, como los intestinos, la nariz y los pulmones.
- Las IgM participan en los antígenos del grupo sanguíneo ABO en la superficie de los glóbulos rojos.
- Las IgM potencian la ingesta de células por fagocitosis.
- Las IgE se unen a los mastocitos y basófilos que participan en la respuesta inmunitaria.
- Algunos científicos piensan que la finalidad de las IgE es detener a los parásitos.
- Las IgD están presentes en la superficie de las células B y juegan un papel en la inducción de la producción de anticuerpos.
.