|
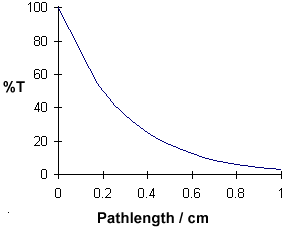
Lunghezza del percorso / cm
|
0
|
0.2
|
0.4
|
0.6
|
0.8
|
1.0
|
|
%T
|
100
|
50
|
25
|
12.5
|
6.25
|
3.125
|
|
Assorbenza
|
0
|
0.3
|
0.6
|
0.9
|
1.2
|
1.5
|
 |
 |
A = ebc ci dice che l’assorbanza dipende dalla quantità totale del composto assorbente nel percorso della luce attraverso la cuvetta. Se tracciamo l’assorbanza contro la concentrazione, otteniamo una linea retta che passa per l’origine (0,0).
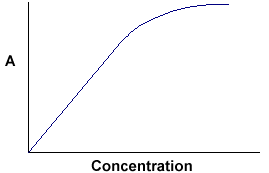 |
Nota che la legge non è rispettata ad alte concentrazioni. Questa deviazione dalla legge non è trattata qui. |
La relazione lineare tra concentrazione e assorbanza è semplice e diretta, ed è per questo che preferiamo esprimere la legge di Beer-Lambert usando l’assorbanza come misura dell’assorbimento piuttosto che la %T.
Questione: Qual è il significato dell’assorbanza molare, e ?
Risposta : Per iniziare riorganizzeremo l’equazione A = ebc :
e = A / bc
In parole, questa relazione può essere dichiarata come “e è una misura della quantità di luce assorbita per unità di concentrazione”.
L’assorbibilità molare è una costante per una particolare sostanza, quindi se la concentrazione della soluzione è dimezzata, lo è anche l’assorbanza, che è esattamente ciò che ci si aspetta.
Prendiamo un composto con un valore molto alto di assorbibilità molare, diciamo 100.000 L mol-1 cm-1, che è in una soluzione in una cuvetta di 1 cm di lunghezza del percorso e dà un’assorbanza di 1.
e = 1 / 1 ´ c
Pertanto, c = 1 / 100.000 = 1 ´ 10-5 mol L-1
Prendiamo ora un composto con un valore molto basso di e, diciamo 20 L mol-1 cm-1 che è in soluzione in una cuvetta di 1 cm di percorso e dà un’assorbanza di 1.
e = 1 / 1 ´ c
Pertanto, c = 1 / 20 = 0.05 mol L-1
La risposta è ora ovvia – un composto con un’alta assorbibilità molare è molto efficace nell’assorbire la luce (della lunghezza d’onda appropriata), e quindi basse concentrazioni di un composto con un’alta assorbibilità molare possono essere facilmente rilevate.
Questione: Qual è l’assorbibilità molare degli ioni Cu2+ in una soluzione acquosa di CuSO4? È 20 o 100.000 L mol-1 cm-1
Risposta : Immagino che tu pensi che il valore più alto sia corretto, perché le soluzioni di solfato di rame che hai visto sono di solito di un bel colore blu brillante. Tuttavia, il valore reale dell’assorbanza molare è di 20 L mol-1 cm-1 ! Il colore blu brillante si vede perché la concentrazione della soluzione è molto alta.
il b-carotene è un composto organico che si trova nelle verdure ed è responsabile del colore delle carote. Si trova a concentrazioni estremamente basse. Non vi sorprenderà sapere che l’assorbibilità molare del b-carotene è di 100.000 L mol-1 cm-1 !
Rivedere quanto appreso
Ora dovresti avere una buona comprensione della legge di Beer-Lambert; i diversi modi in cui possiamo riportare l’assorbimento, e come si relazionano tra loro. Dovresti anche capire l’importanza dell’assorbibilità molare, e come questa influenza il limite di rilevazione di un particolare composto.
![]()