W 1889 roku, Svante Arrhenius zaproponował równanie Arrheniusa na podstawie bezpośrednich obserwacji wykresów stałych szybkości w zależności od temperatury:
Energia aktywacji, Ea, jest minimalną energią, jaką muszą posiadać cząsteczki, aby zareagować w celu utworzenia produktu. Nachylenie wykresu Arrheniusa może być użyte do znalezienia energii aktywacji. Wykres Arrheniusa może być również użyty poprzez ekstrapolację linii z powrotem do punktu przecięcia y, aby uzyskać współczynnik pre-eksponencjalny, A. Współczynnik ten jest istotny, ponieważ A=p×Z, gdzie p jest współczynnikiem sterycznym, a Z jest częstotliwością kolizji. Współczynnik preekponencjalny, lub częstotliwość, jest związany z ilością uderzeń cząsteczek w orientacji niezbędnej do wywołania reakcji. Należy zauważyć, że równanie Arrheniusa oparte jest na teorii zderzeń. Mówi ona, że cząsteczki muszą zderzać się w odpowiedniej orientacji i z odpowiednią energią. Teraz, gdy uzyskaliśmy energię aktywacji i współczynnik pre-eksponencjalny z wykresu Arrheniusa, możemy rozwiązać stałą szybkości w dowolnej temperaturze za pomocą równania Arrheniusa.
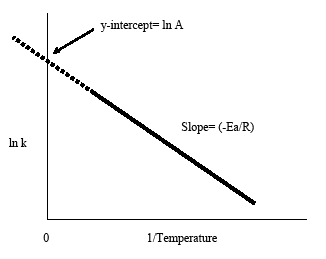
Wykres Arrheniusa uzyskuje się przez wykreślenie logarytmu stałej szybkości, k, względem odwrotności temperatury, 1/T. Powstała w ten sposób ujemnie nachylona linia jest przydatna do znalezienia brakujących składników równania Arrheniusa. Ekstrapolacja linii z powrotem do punktu przecięcia z linią y daje wartość ln A. Nachylenie linii jest równe ujemnej energii aktywacji podzielonej przez stałą gazową R. Zasadą w większości reakcji biologicznych i chemicznych jest podwajanie szybkości reakcji, gdy temperatura wzrasta co 10 stopni Celsjusza.
Patrząc na równanie Arrheniusa, mianownik funkcji wykładniczej zawiera stałą gazową, R, oraz temperaturę, T. Tak jest tylko w przypadku, gdy mamy do czynienia z molami substancji, ponieważ R ma jednostki J/molK. Gdy mamy do czynienia z cząsteczkami substancji, stała gazowa w dominancie funkcji wykładniczej równania Arrheniusa jest zastąpiona stałą Boltzmanna, kB. Stała Boltzmanna ma jednostki J/K. W temperaturze pokojowej, kBT, jest dostępną energią dla cząsteczki w 25 C lub 273K i jest równa około 200 liczbom falowym.
Należy zauważyć, że decyzja o użyciu stałej gazowej lub stałej Boltzmanna w równaniu Arrheniusa zależy przede wszystkim od anulowania jednostek. Aby przyjąć odwrotność logarytmu liczby, liczba ta musi być pozbawiona jednostek. Dlatego wszystkie jednostki we współczynniku wykładniczym muszą się znieść. Jeżeli energia aktywacji jest wyrażona w dżulach na mol, wówczas w dominancie należy użyć stałej gazowej. Jednakże, jeśli energia aktywacji jest w jednostkach dżuli na cząsteczkę, wtedy należy użyć stałej K.
- Równanie Arrheniusa na mol
- Równanie Arrheniusa na cząsteczkę
„Zlinearyzowane” równanie Arrheniusa
Równanie Arrheniusa (równanie \{eq1}) może być przekształcone, aby poradzić sobie z konkretnymi sytuacjami. Na przykład, przyjmując logarytm z obu stron otrzymujemy powyższe równanie w postaci y=-mx+b.
Wtedy można znaleźć wykres \(\n k) vs. \(1/T) i wszystkich zmiennych.
- (y=ln k)
- (m=-Ea/RT)
- (x=1/T)
- (b=ln A)
Ta postać równania Arrheniusa ułatwia wyznaczenie nachylenia i y-interceptu z wykresu Arrheniusa. Wygodnie jest również zauważyć, że powyższe równanie pokazuje związek pomiędzy temperaturą a stałą szybkości. Wraz ze wzrostem temperatury, zgodnie z wykresem, stała szybkości maleje. Z tego związku możemy wywnioskować, że stała szybkości jest odwrotnie proporcjonalna do temperatury.
Forma zintegrowana
Przydatna jest również forma zintegrowana równania Arrheniusa (równanie \{eq3}). Ta odmiana równania Arrheniusa polega na wykorzystaniu dwóch działek Arrheniusa skonstruowanych na tym samym wykresie do wyznaczenia energii aktywacji. Powyższe równanie pokazuje wpływ temperatury na wiele stałych szybkości. Pozwala to na łatwe wnioskowanie o wrażliwości stałych szybkości na energię aktywacji i zmiany temperatury. Jeśli energia aktywacji jest wysoka dla danego zakresu temperatur, to stała szybkości jest bardzo wrażliwa; zmiany temperatury mają znaczący wpływ na stałą szybkości. Jeśli energia aktywacji jest niska dla danego zakresu temperatur, wówczas stała szybkości jest mniej wrażliwa, a zmiany temperatury mają niewielki wpływ na stałą szybkości. Zjawisko to przedstawiono graficznie w poniższym przykładzie:
| 1/Temp | 0.0085 | 0.0075 | 0.0065 | 0.0055 | 0.0045 | 0.0035 |
|---|---|---|---|---|---|---|
| lnk (large Ea) | 3 | 2.5 | 2 | 1.5 | 1 | 0.5 |
| lnk (małe Ea) | 1.8 | 1.7 | 1.6 | 1.5 | 1.4 | 1.3 |
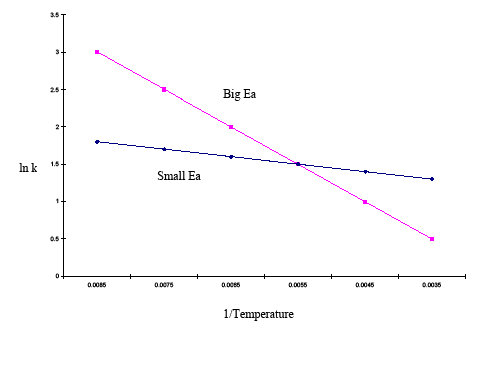
Wykres powyżej pokazuje, że działka o większym nachyleniu ma większą energię aktywacji, a działka o bardziej płaskim nachyleniu ma mniejszą energię aktywacji. Oznacza to, że w tym samym zakresie temperatur reakcja o wyższej energii aktywacji zmienia się szybciej niż reakcja o niższej energii aktywacji.
Znaczenie biologiczne
Wykres Arrheniusa może stać się nieliniowy, jeśli etapy stają się ograniczające w różnych temperaturach. Taki przykład można znaleźć u Foxa i współpracowników w 1972 r. w przypadku transportu beta-glikozydu w E. coli. Różnice w temperaturach przejścia wynikają ze składu kwasów tłuszczowych w błonach komórkowych. Różnica stanów przejściowych jest wynikiem gwałtownej zmiany płynności błony. Inny przykład obejmuje nagły spadek przy niskim 1/T (wysokie temperatury), wynik denaturacji białka.
Kluczowe punkty
- Wykresy Arrheniusa pokazują, że szybkość reakcji jest odwrotnie proporcjonalna do zmian temperatury
- Ujemne nachylenie z wykresu Arrheniusa daje energię aktywacji, Ea: slope = -Ea/R
- Extrapolacja wykresu Arrheniusa z powrotem do punktu przecięcia y daje lnA
- Wykres Arrheniusa pokazuje, jak energia aktywacji i temperatura wpływają na wrażliwość szybkości reakcji
Problemy praktyczne
1. T/F Ea obliczona z równania Arrheniusa daje dokładną wartość.
2. Opisać zależność między temperaturą a Ea i podać przykłady.
3. Korzystając z poniższych informacji:
A= 1×1014sec-1
Ea= 75×103 J/mol
R= 8,314 J mol/K
Oblicz k w temperaturze 27° C z odpowiednimi jednostkami.
4. Korzystając z informacji z zadania 3, oblicz k w temperaturze 37° C z odpowiednimi jednostkami.
5. Korzystając z równania całkowego rozwiąż dla Ea używając:
k1=7.78×10-7 w T1=273 K
k2=3.46×10-5 w T2=298 K
Odpowiedzi
- Fałsz: Ea jest wartością średnią lub „pozorną”.
- W miarę wzrostu temperatury, stała szybkości maleje, gdy powyższe równanie jest wykreślone. To samo jest prawdą, gdy temperatura maleje, stała szybkości wzrasta. Z tego związku wynika, że stała szybkości jest odwrotnie proporcjonalna do temperatury.
- k= 8,727 sek-1
- k=23,02 sek-1
- Ea=1.026×105 J/mol
Wykonawcy i udziałowcy
- David Johns i Andra Hutton (UC Davis)