Fakty, Podsumowanie & Definicja
- Allosteryczne enzymy to enzymy, które mają dodatkowe miejsce dla efektora, do którego mogą się wiązać, oprócz miejsca aktywnego
- Efektory regulują aktywność enzymu – mogą albo aktywować, albo hamować
- Allosteryczne enzymy są większe i bardziej złożone niż normalne enzymy
- Są regulowane poprzez regulację homotropową lub regulację heterotropową
Czym są enzymy allosteryczne?
Pamiętasz, że enzymy są klasyfikowane jako biologiczne katalizatory. Oznacza to, że pomagają one przyspieszyć szybkość reakcji, ale pozostają niezmienione podczas całego procesu.
Ezymy allosteryczne to enzymy, które mają dodatkowe miejsce, oprócz miejsca aktywnego – pochodzi to od greckiego „allo”, co oznacza „inny”. Nazywa się je miejscami allosterycznymi, a enzymy mogą mieć ich więcej niż jedno. Są one wyjątkowe, ponieważ mają zdolność reagowania na wiele różnych warunków w ich bezpośrednim otoczeniu. Ponadto, kiedy enzymy allosteryczne są przedstawione na wykresie jako prędkość w stosunku do stężenia substratu, pokazują krzywą sigmoidalną, a nie zwykłą krzywą hiperparaboliczną.
Niżej znajduje się obrazek przedstawiający ogólny enzym allosteryczny.

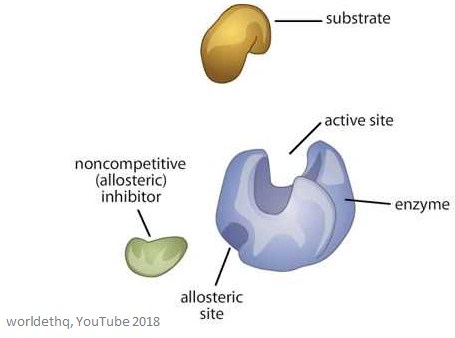
Właściwości enzymów allosterycznych
Miejsca allosteryczne są miejscami wiązania na enzymie – różnią się od miejsca aktywnego i miejsca wiązania substratu.
Cząsteczka, która wiąże się z miejscem allosterycznym nazywana jest efektorem (może być również nazywana modulatorem) i reguluje aktywność enzymu, z którym się wiąże.
Aktywność enzymu wzrasta, gdy pozytywny efektor wiąże się z miejscem allosterycznym. Oznacza to, że aktywność enzymu jest zmniejszona, gdy negatywny efektor allosteryczny wiąże się z miejscem allosterycznym – hamują one enzym.
Allosteryczne enzymy są większe i bardziej złożone niż enzymy nieallosteryczne i często mają wiele podjednostek. Enzymy posiadające więcej niż jeden efektor mają różne i specyficzne miejsca wiązania dla każdego z nich. W większości enzymów allosterycznych, miejsce wiązania substratu i miejsce wiązania efektora znajdują się na różnych podjednostkach.
Miejsce wiązania substratu znajduje się na podjednostce katalitycznej – często określanej jako podjednostka C. Miejsce wiązania efektora znajduje się na podjednostce regulatorowej – często nazywanej podjednostką R.
Gdy cząsteczka efektora w jednym miejscu wiązania powoduje zmianę konformacyjną tej podjednostki, zmiana konformacyjna jest następnie wywoływana w innych podjednostkach białka – oznacza to, że ogromna część energii wiązania efektora jest wykorzystywana do zmiany konformacji całego kompleksu białkowego.
To oddziaływanie pomiędzy wszystkimi podjednostkami można wyrazić za pomocą współczynnika Hilla – jest on również nazywany współczynnikiem kooperatywności. Gdy n=1, nie będzie żadnych interakcji między podjednostkami enzymu. Im większy jest współczynnik Hilla (współczynnik kooperatywności), tym silniejsze są interakcje między wszystkimi podjednostkami enzymu.
Allosteryczne enzymy mogą również „przełączać się” między formą aktywną a nieaktywną. Pozwala to na tworzenie wyrafinowanych wzorców aktywności, które mogą odgrywać ogromną rolę w funkcjach biologicznych. Kiedy efektor odłączy się od miejsca wiązania, enzym jest w stanie powrócić do swojej nieaktywnej (lub mniej aktywnej) formy. Mogą one kontrolować szybkość bardzo ważnych reakcji, takich jak produkcja ATP.
Gdy efektor wiąże się z enzymem, nazywa się to wiązaniem kooperacyjnym.
Regulacja homotropowa
Homotropowy efektor allosteryczny jest zarówno substratem dla enzymu, jak i cząsteczką regulacyjną – przedrostek „homo” odnosi się do tego, że są one takie same. Zazwyczaj są one aktywatorami enzymu. Poniższy obrazek przedstawia homotropowy efektor allosteryczny.

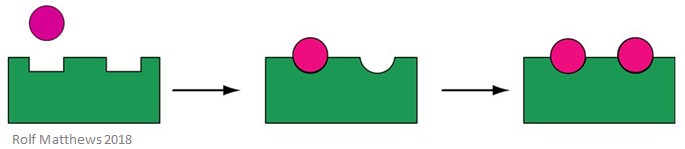
Dobrym przykładem homotropowego efektora allosterycznego jest tlen (O2) – działa on jako efektor hemoglobiny w organizmie człowieka.
Regulacja heterotropowa
Heterotropowy efektor allosteryczny to cząsteczka regulatorowa, która nie jest jednocześnie substratem dla enzymu. Może on albo aktywować, albo hamować enzym, z którym się wiąże. Poniższy rysunek przedstawia heterotropowy efektor allosteryczny.

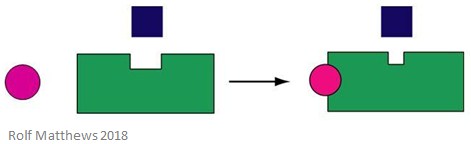
Dobrym przykładem heterotropowego efektora allosterycznego jest dwutlenek węgla (CO2) – działa on również jako efektor hemoglobiny, ale nie jest substratem enzymu.
Essential Activators
Essential activators to allosteryczne aktywatory, bez których aktywność enzymu byłaby tak niska, że byłaby pomijalna. Na przykład, N-acetyloglutaminian jest niezbędnym aktywatorem dla syntetazy fosforanu karbamoilu I. Są one dokładnym przeciwieństwem inhibitorów enzymatycznych.