Jak działają bufory
Jak widzieliśmy przy obliczaniu pH roztworów, tylko niewielka ilość silnego kwasu jest potrzebna, aby drastycznie zmienić pH. W niektórych eksperymentach pożądane jest jednak utrzymanie stałego pH, gdy kwasy lub zasady są dodawane do roztworu w wyniku reakcji lub przez eksperymentatora. Chemicy rutynowo używają buforów do regulacji pH reakcji. Biologia znajduje różnorodne zastosowania dla buforów, od kontroli pH krwi do zapewnienia, że mocz nie osiągnie boleśnie kwaśnego poziomu.
Bufor jest po prostu mieszaniną słabego kwasu i jego sprzężonej zasady lub słabej zasady i jej sprzężonego kwasu. Bufory działają poprzez reakcję z każdym dodanym kwasem lub zasadą, aby kontrolować pH. Na przykład, rozważmy działanie buforu składającego się ze słabej zasady – amoniaku, NH3, i jego sprzężonego kwasu, NH4+. Kiedy do buforu dodawany jest HCl, NH3 „wchłania” proton kwasu, przekształcając się w NH4+. Ponieważ ten proton jest zamknięty w jonie amonowym, nie służy on do znacznego zwiększenia pH roztworu.Kiedy NaOH jest dodawany do tego samego buforu, jon amonowy oddaje proton do zasady, aby przekształcić się w amoniak i wodę.Tutaj bufor służy również do neutralizacji zasady.
Jak pokazuje powyższy przykład, bufor działa poprzez zastąpienie silnego kwasu lub zasady słabym. Proton mocnego kwasu jest zastąpiony jonem amonowym, słabym kwasem. Silna zasada OH- została zastąpiona słabą zasadą amoniakiem. Te zamiany mocnych kwasów i zasad na słabsze dają buforom ich niezwykłą zdolność do moderowania pH.
Obliczanie pH roztworów buforowanych
Bufory muszą być dobrane do odpowiedniego zakresu pH, który mają kontrolować. Zakres pH roztworu buforowego jest podany przez równanie Hendersona-Hasselbalcha. W celu wyprowadzenia tego równania, wyobrazimy sobie bufor składający się z kwasu, HA, i jego sprzężonej zasady, A-. Wiemy, że stała dysocjacji kwasu pKa jest dana następującym wyrażeniem:

Równanie to można przekształcić w następujący sposób:
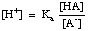
Obliczając logarytm tego wyrażenia i zmieniając kolejność członów tak, aby każdy z nich był dodatni, otrzymujemy równanie Hendersona-Hasselbalcha: