Wprowadzenie
Od czasu pierwszego klinicznego opisu reumatoidalnego zapalenia stawów (RZS) pannus odgrywa kluczową rolę w rozwoju choroby, a jego zrozumienie poprawiło się wraz z rozwojem technik histologicznych, biologii molekularnej i obrazowania.
W klinice pannus jest uważany za późną, nieaktywną i nieodwracalną manifestację choroby, chociaż termin ten jest czysto histologiczny. Zamieszanie staje się coraz bardziej widoczne, gdy mamy do czynienia z klinicznym monitorowaniem RZS i używaniem takich terminów, jak pannus, synovitis, czy przewlekłe zapalenie błony maziowej, co powoduje rozmycie pojęcia o aktywności choroby.
Dla potrzeb tego przeglądu przeprowadzono wyszukiwanie literatury w Pubmed i Embase, używając terminów pannus, rheumatoid arthritis, ultrasonography, magnetic resonance, od 1900 do 2015 roku. Przeszukano również nieindeksowane teksty i książki na ten temat, w celu dokonania narracyjnego i historycznego opisu pannusa, jego rozwoju i patologicznej roli w RZS.
Wstępny kliniczny i histologiczny opis pannusa w reumatoidalnym zapaleniu stawów
Chociaż podobne terminy do RZS były używane przed 1859 r., to jednak Garrod (ryc. 1), który w rozdziale XV swojej książki „The nature and treatment of gout and rheumaticgout „1,2 dokładnie opisał chorobę, jaką znamy dzisiaj, odróżniając ją od podagry i gorączki reumatycznej. Przedstawił szczegółowe ilustracje (ryc. 2) typowych zniekształceń i podkreślił poważny charakter choroby w porównaniu z innymi schorzeniami, ze względu na trudności w kontrolowaniu choroby i jej upośledzający rozwój kliniczny (ryc. 3).

Fotografia Sir. Alfreda Baringa Garroda, 1819-1907.3
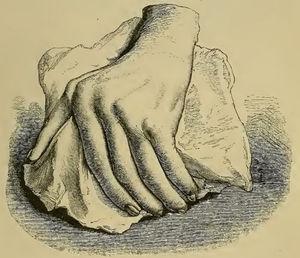
Ilustracja z książki Garroda przedstawiająca zniekształconą rękę z odchyleniem łokciowym będącym następstwem reumatoidalnego zapalenia stawów.1,2
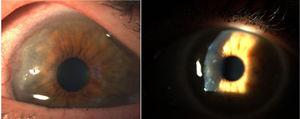
Corneal pannus.8
Mimo bardzo dokładnego opisu klinicznego RZS, Garrod nie wspomniał o zajęciu stawów z histopatologicznego punktu widzenia. Dziesiątki lat później William Ord, lekarz ze Szpitala św. Tomasza w Londynie w swoim manuskrypcie opublikowanym w British Medical Journal w 1880 r. starał się wyjaśnić pewne wątpliwości dotyczące terminu RZS, który, jak zauważył, był często używany w sposób niespecyficzny do klasyfikacji różnych chorób. Ord zasugerował, że termin RZS powinien być stosowany jedynie w odniesieniu do zapalenia stawów z wysiękiem, odmiennego od podagry, gorączki reumatycznej (reumatyzmu) czy skrofuły, które charakteryzuje się zanikiem kości i chrząstek, a także przerostem błony maziowej. Stwierdzenie to wskazywało na związek z patofizjogenezą RZS.4
W 1905 i 1909 roku Nichols i Richardson w swoich pracach opublikowanych odpowiednio w Journal of Medical Research i Boston Medical and Surgical Journal5 przedstawili jeden z najlepszych kliniczno-patologicznych opisów chorób reumatycznych i wyróżnili 2 grupy pacjentów: jedną z cechami klinicznymi zbliżonymi do RZS i drugą z cechami choroby zwyrodnieniowej stawów.6. Niezależnie od tego, że oba artykuły Nicholsa i Richardsona odnoszą się do przypadków nieropnego zniekształcającego zapalenia stawów, dokładne przedstawienie objawów klinicznych, uzupełnione zdjęciami i obrazami radiologicznymi, wyraźnie obrazuje przypadki RZS. Autorzy ci zestawili również szereg próbek histologicznych z 75 przypadków klinicznych, dochodząc do ważnego wniosku: istnieją dwa wzorce histologiczne zajęcia stawów, jeden polegający na pogorszeniu stanu chrząstki stawowej, a drugi na pogrubieniu błony maziowej. To ostatnie jest ściśle związane z inwazją tkanki kostnej i chrząstki stawowej, powodując destrukcję i niekiedy bezładną neoformację kostną. W tej samej publikacji Nicholsa i Richardsona znajduje się opis proliferacyjnego zapalenia stawów z tworzeniem bardzo unaczynionej tkanki ziarninowej, z komponentą komórkową pochodzenia mezenchymalnego, głównie błony maziowej i tzw. tkanki pancernej. Po raz pierwszy użyto terminu articular pannus.5 Należy podkreślić, że termin pannus był już w tym czasie używany w okulistyce do opisu pewnego rodzaju zmian w rogówce i został zdefiniowany przez American Academy of Ophthalmology jako włóknisty i naczyniowy rozrost tkanki pomiędzy nabłonkiem a błoną Bowmana, często występujący w przypadkach przewlekłego obrzęku rogówki, w następstwie stanu zapalnego rogówki7 (ryc. 7). W obu przypadkach, pannusa synowialnego i pannusa rogówkowego, opisywane zmiany przypominają pannus, łacińskie słowo oznaczające „tkaninę”.
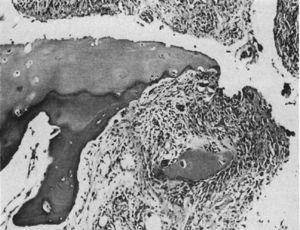
Wykonanie badania histologicznego w mikroskopii świetlnej. Zmiana destrukcyjna na marginesie stawu międzypaliczkowego. Tkanka maziowa lub pannus może być doceniona obok tkanki ziarninowej – tzw. ruch klamrowy izolujący fragment chrząstki oznaczony jako „C”.9
Niektóre obrazy i opisy w opracowaniu Nicholsa i Richardsona z 19095 r. przedstawiono na rycinach. 4-6.
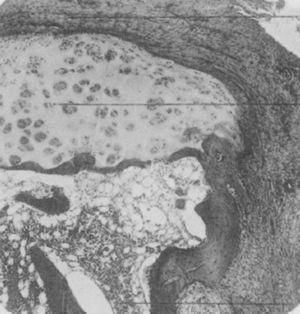
Zdjęcie w mikroskopii świetlnej paliczka dystalnego u pacjenta cierpiącego na chorobę zwaną wówczas proliferacyjnym zapaleniem stawów typu ekstremalnego. Widać na nim tworzenie się grubej tkanki ziarninowej wnikającej i niszczącej chrząstkę stawową.5,6
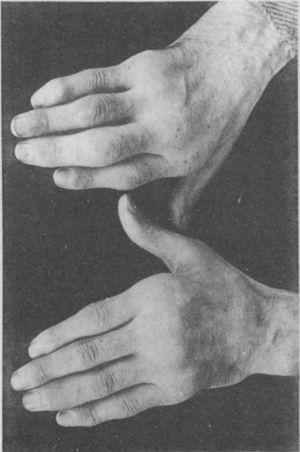
Zdjęcie rąk 35-letniego pacjenta z wywiadem gonokokowego zapalenia cewki moczowej, u którego po latach stopniowo rozwinęło się zapalenie wielostawowe małych i dużych stawów. Klasyfikowany jako proliferacyjne zapalenie stawów.5,6
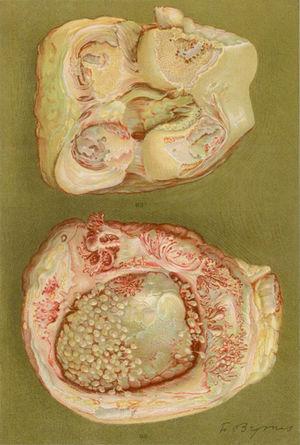
Rysunek z nekropsji 40-letniej kobiety z kliniką zapalenia wielostawowego dużych i małych stawów prowadzącego do znacznego inwalidztwa i ankyloz. Istnieją dowody na utratę chrząstki stawowej i stref tworzenia kości, co prowadzi do ankyloz kolan.5,6
W 1959 r. Kulka opublikował przegląd patogenezy RZS,9 wykorzystując pracę Nicholsa i Richardsona5 jako punkt odniesienia, w której sklasyfikował zmiany histologiczne w RZS w 3 typach: Pierwszy typ sklasyfikowano jako zmiany zapalne błony maziowej, drugi jako zwyrodnienie i martwicę tkanki łącznej, a trzeci jako nacieki zapalne naczyń w tętniczkach i żyłkach. Pierwszy typ zmian odpowiada opisanemu w 1909 roku przez Nicholsa i Richardsona pannusowi, polegającemu na zgrubieniu błony maziowej powodującym resorpcję chrząstki. Kulka stwierdził za pomocą mikroskopii świetlnej, że z jednej strony zmianę destrukcyjną chrząstki charakteryzuje przewlekle zapalny rozrost tkanki maziowej – czyli pannus, a z drugiej strony, że tkanka ziarninowa, która rozrastając się z przestrzeni podchrzęstnych szpiku kostnego i przedostając się przez blaszkę podchrzęstną, przyczepia się do pannusa i otacza go ruchem czepnym, może postępować w kierunku izolowania fragmentów chrząstki brzeżnej (ryc. 7).9
Kulka w swojej pracy określił kryteria histologiczne pozwalające na rozpoznanie RZS, jeśli spełnione są co najmniej 3 z 5 charakterystycznych cech, przy braku innego prawdopodobnego rozpoznania:
-
Proliferacja komórkowa
-
Proliferacja komórek powierzchownych błony maziowej, zwykle palisadowy
-
Znaczony naciek komórek zapalnych (limfocytów lub komórek plazmatycznych) z tendencją do tworzenia guzków limfatycznych
-
Złożony osad fibrynowy
Ale podkreślono, że żadna z tych cech nie jest specyficzna, Połączenie 3 lub więcej cech przy braku innych patologii miało istotną wartość diagnostyczną dla RZS (ryc. 8). 8).

Histologia w mikroskopii świetlnej. Klasyczne zapalenie błony maziowej stawu kolanowego w RZS przedstawiające przerost błony maziowej, nacieki naczyniowe i guzki limfoidalne z ośrodkiem germinalnym w prawym rogu.9
Mikroskopia elektronowa i model guza pannus
W 1975 roku Kobayachi i Ziff10 przeprowadzili badania mikroskopii elektronowej pannusu i jego przyczepu do chrząstki, aby przyczynić się do zrozumienia uszkodzenia stawów. Chociaż już w 1961 r.11 Ziff opisał zmiany w błonie maziowej, obaj autorzy stwierdzili, że wewnątrz pannusa mogą rozwijać się proteazy lizosomalne, które degradują śluzoproteiny chrząstki i mogą być wydzielane do określonych miejsc, takich jak brzegi stawowe, gdzie dochodzi do początkowego wytwarzania pannusa; innymi słowy, na styku błony maziowej i chrząstki stawowej.12
Badacze ci przeanalizowali próbki z połączenia błony maziowej i chrząstki u 8 pacjentów z rozpoznaniem RZS i zidentyfikowali 3 typy zmian: pierwszy z naciekiem komórek jednojądrowych w naczyniach wnikających do chrząstki, sporadycznie tworzących gniazda komórkowe lub agregaty wewnątrz macierzy chrząstki (oprócz komórek plazmatycznych, limfocytów i granulocytów). Ponadto wewnątrz tych gniazd znajdowano również rozpuszczony krążący kolagen, co nasuwa teorię o wydzielaniu enzymu proteolitycznego (ryc. 9). Drugi typ zmian odpowiada bezpośredniej inwazji na chrząstkę komórek monocytarnych i słabo zróżnicowanych fibroblastów, które mogą manifestować się jako fagocytarne lub fibroblastyczne, z amorficzną cytoplazmatyczną ziarnistą zawartością z wydłużeniami komórek, które degradują chrzęstną macierz kolagenową i mogą być widoczne wewnątrz rozszerzeń komórkowych (ryc. 10). Trzeci typ zmiany przedstawia się jako gruba warstwa włóknistej i unaczynionej tkanki pokrywającej chrząstkę i zakłócającej normalne unaczynienie chrząstki stawowej.

Obraz z mikroskopu elektronowego przedstawiający fibroblasty z zanurzonymi lizosomami (Lys) i licznymi rozszerzeniami cytoplazmatycznymi wdzierającymi się do macierzy chrząstki (Ctm).10
Przez następne 2 dekady wiodąca rola pannusa w patofizjologii choroby stawów w RZS nie ograniczała się tylko do opisu destrukcji chrząstki. Edward Harris w 1990 roku13 opublikował jeden z najbardziej wyczerpujących przeglądów patofizjologii RZS, klasyfikując je na 5 typów, zgodnie z immunologiczną charakterystyką uszkodzenia stawów. Opisał on, że w początkowych stadiach (stadium 2) rolę odgrywa niezgrubiała błona maziowa oraz neowaskularyzacja makrofagów pod wpływem cytokin14 z nagromadzeniem okołonaczyniowych limfocytów15. Jak wcześniej wykazał Kobayashi10 za pomocą mikroskopii elektronowej, limfocyty – głównie T CD4+16 z niewielką liczbą limfocytów T regulatorowych17 – aktywują miejscowe limfocyty B dojrzewające do produkujących przeciwciała komórek plazmatycznych w tkance maziowej,18 upośledzając tę tkankę w ramach początku i progresji choroby. Harris twierdził również, że w bardziej zaawansowanych stadiach choroby (stadium 4) dochodzi do obfitej proliferacji błony maziowej z nawet 100-krotnym zwiększeniem jej normalnej masy, co zostało zinterpretowane jako zachowanie podobne do guza ze zwiększoną aktywnością komórkową synowiocytów, co zostało potwierdzone we wzbogaconym podłożu hodowlanym, w którym komórki rosły izolowane i autonomicznie,19 co doprowadziło do rozważenia po raz pierwszy modelu onkogenów, podobnie jak ma to miejsce w nowotworach.
Komponenty komórkowe pannusa
Chociaż kilku badaczy kontynuowało badania nad komponentem pogrubiałej tkanki lub pannusa, nie osiągnięto porozumienia co do jego patogenezy. W 1983 r. Burmester i wsp.20 badali komórki nielimfocytarne pannusa za pomocą przeciwciał monoklonalnych skierowanych przeciwko antygenom makrofagów i fibroblastów. Zidentyfikowali oni 3 typy komórek linii synovia; pierwszy z nich to w większości (40% ogółu) komórki monocytarne lub makrofagi o zdolnościach fagocytarnych, z receptorami Fc i ekspresją HLA DR lub typu II. Drugi typ komórek był podobny do monocytów, ale nie fagocytujący, z ekspresją HLA-DR i nie znaleziono innych antygenów monocytarnych. Ostatnia znaleziona linia komórkowa była pozytywna dla markerów fibroblastów, ale bez ekspresji HLA-DR lub innych antygenów monocytarnych (od 20% do 40% ogółu), co zostało potwierdzone w 1987 roku przy użyciu sklonowanych komórek i hodowli komórkowych.21 Znaczenie tych komórek maziowych polegało między innymi na aktywacji proto-onkogenu c-jun w odpowiedzi na bodziec IL-a,22 który jest podobny do komórek nowotworowych zwiększających ekspresję kolagenazy ze zdolnością do niszczenia, wraz ze stromelizyną i innymi metaloproteinazami, macierzy chrzęstnej i kostnej,23,24 co wcześniej przypisywano Ziffowi w 1960 roku.11
Zvaifler i Firestein25 w 1994 roku uznali, że pochodzenie pannusu jest niejasne, a dowody dzielą go na przewlekle zapalną tkankę maziową oraz wyspecjalizowaną, silnie unaczynioną tkankę łączną, która zaczyna się w interfazie maziowo-kostnej i historycznie była określana jako miejsce rozpoczęcia procesu destrukcyjnego.5,10,26,28 W niniejszym opracowaniu rozważano dwie możliwości pochodzenia synowiocytów, które są podobne do fibroblastów i którym nadano nazwę pannocytów.20 Pierwsza hipoteza głosi, że niedojrzałe komórki mezenchymalne jako pierwsze wkraczają do naczyń wnikających do chrząstki, które mogą być zastąpione lub ewoluować w kierunku fibroblastów,27 w procesie, w którym pośredniczą nieznane czynniki zapalne (czynnik X), niezależne od czynników immunologicznych pochodzących z komórek T, co wykazano również w modelach zwierzęcych.29,30 Druga mniej poparta hipoteza, a oparta na badaniach przeprowadzonych na początku lat 90. XX wieku,31-33 była zależna od cytokin limfocytów i opisywała zmniejszoną ekspresję genomu limfocytów i produktów limfocytarnych w tkankach i w płynie maziówkowym (ryc. 11).

Alternatywne szlaki, poprzez które nieznany czynnik „X” w RZS mógłby indukować powstawanie pannusa. Może on rozpoczynać się poprzez szlak zależny od komórek T lub poprzez szlak synowiocytów.25
Przegląd autorstwa Zvaiflera i Firesteina25 próbuje zrozumieć, nie tylko pochodzenie, ale utrwalanie się pannusa, w oparciu o 2 możliwości: jedna – jak wspomniano jeszcze w 1989 roku – rozważa model nowotworowy, w którym komórki maziówki ulegają transformacji pod wpływem sygnału wyzwalającego proliferację i indukującego ekspresję onkogenów oraz produkcję enzymów degradujących macierz lub białka adhezyjne.34,35 Sygnały te mogą pochodzić od rozpuszczalnych cząsteczek, takich jak cytokiny, lub od nieokreślonych czynników etiologicznych. Z tej perspektywy tkanki takie jak chrząstka czy kość, nie biorą udziału w ich rozwoju, ale są dotknięte pannusem. Druga możliwość opiera się na założeniu, że to związki generowane przez chondrocyty lub kompleksy immunologiczne zanurzone w chrząstce są odpowiedzialne za aktywację synowiocytów do inwazji na tkankę i opuszczenia swojego naturalnego środowiska.
Jednakże proces, w którym fibroblastopodobne synowiocyty, pozbawione receptorów Fc, zostają dotknięte tymi kompleksami immunologicznymi36 nie został ustalony, ale prawdopodobnie pośredniczą w nim komórki monocytarno-makrofagowe. Prawdopodobnym wyjaśnieniem tego zdarzenia jest wiązanie się białek dopełniacza i kompleksów immunologicznych z witronektyną i jej receptorami, co wpływa na różnicowanie, migrację i proliferację fibroblastów i co jest następnie wzmacniane przez kontakt tych komórek z kolagenem, fibronektyną i innymi metaloproteinazami,37,38 poprzez ekspresję receptorów, takich jak VCAM-1, która do tego czasu była jedyną znaną cząsteczką adhezyjną ulegającą nadekspresji w fibroblastach synowiocytów.39
Zgodnie z tym drugim scenariuszem chrząstka będzie nie tylko tkanką dotkniętą pancerzem, ale także czynnikiem indukującym i utrwalającym tę odpowiedź. Niezależnie od powyższego, nadal jest jasne, że konserwacja pannusa zależy od cytokin stymulujących wzrost komórek i produkcji enzymów syntetyzowanych przez synowiocyty pochodzące z monocytów40 oraz synowiocyty fibroblastopodobne. Wykazano in vitro, że enzymy te były syntetyzowane41 poprzez regulację i pośrednictwo limfocytów T, monocytów i ich produktów ubocznych, które stanowią większość komórek w pancerzu.42
Praca Burmestera z 1983 roku20 miała fundamentalne znaczenie dla kontynuacji badań nad komórkowym komponentem pancerza. Grupa Xue w 1997 r. badała próbki artroplastyki zawierające pannus pacjentów z RZS i zaobserwowała komórki PSC, które były fenotypowo badane za pomocą mikroskopii i immunohistochemii, ze specyficzną ekspresją białka i genomu.43 Komórki te okazały się pozytywne dla filamentów wimentyny, markerów immunofluorescencji (ryc. 12) i były morfologicznie podobne do fibroblastów pod mikroskopem. Jednakże marker safraniny O, który reaguje z proteoglikanami (ryc. 13), jak również ekspresja mRNA kolagenu typu II, który jest używany do identyfikacji komórek chondrocytopodobnych, były również pozytywne; stąd wniosek, że komórki te są połączeniem fibroblastów i chondrocytów.
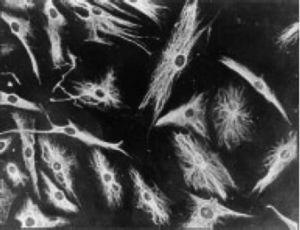
Mikrograf immunofluorescencyjny pokazujący dodatniość komórek PSC w stosunku do przeciwciał anty-wimentyny znakowanych izotiocyjanianem fluoresceiny. Jest to podobne do wyników uzyskanych w fibroblastach.43
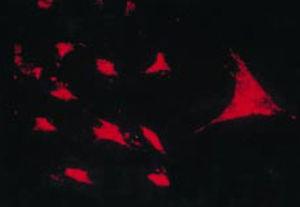
Atest odwrotnej transkryptazy in situ w celu wykazania ekspresji RNA kolagenu typu II w hodowli PSC, który przekazuje cechy chondrocytów.43.
Badanie ekspresji genomu potwierdziło również wysoką aktywność proto-onkogenów dla c-myc, c-jun i c-fos, które umożliwiają wysoką produkcję enzymów, takich jak katepsyna B i L oraz niektóre kolagenazy.
W późniejszych latach ujawniono dalsze dowody dotyczące cech tkanki we wczesnej chorobie stawów oraz zwiększonej ekspresji genu p53,44 mutacji, które częściej obserwowano w zaawansowanych stadiach choroby.45 W 2003 roku Smeets i wsp. zaobserwowali różnice w charakterystyce komórkowej, ekspresji cytokin, czynników angiogennych i metaloproteinaz panewki uzyskanej z próbek pobranych od pacjentów z późną chorobą, poddanych wymianie stawu bez objawów klinicznej aktywności zapalenia stawów, w porównaniu z pacjentami poddanymi artroskopii i uznanymi za będących we wczesnym stadium choroby, ponieważ nadal wykazywali kliniczną aktywność zapalenia stawów.46 Różnice między obiema grupami polegały na większej liczbie makrofagów i limfocytów T pochodzących z materiału po artroskopii lub z wczesnego stadium choroby oraz na większej ekspresji TNF-a, IL-6, metaloproteinaz (MMP-1, MMP-3, MMP-13) i czynnika angiogenezy (VEGF).
Pannus jest często uważany za tkankę włóknistą bez większej aktywności biologicznej i pozostałość po uszkodzeniu stawu, które wydaje się nieodwracalne. Jednakże, pannus zachowuje się jak medium produkujące duże ilości enzymów proteolitycznych, o centralnej roli patologicznej, takich jak MMP 1, 3, 13 i 14.47 MMP 3 lub stromelina (wspomniana powyżej)23,24,48 w szczególności, jest intensywnie produkowana, jak wykazano w 2005 roku49 poprzez wykrywanie mRNA na styku błony maziowej i chrząstki, i jest zależna od IL-1b w stymulacji syntezy. MMP 3 różni się od MMP 1 lub kolagenazy typu 1, ponieważ występuje w mniejszej ilości i jest stymulowana przez TNF-a.
Pannus a jądrowy czynnik kappa B
Jądrowy czynnik transkrypcyjny kappa B (NF-kB) jest jednym z najważniejszych regulatorów genomowej transkrypcji cytokin, chemokin i cząsteczek adhezyjnych; Odgrywa rolę w degradacji chrząstki i kości stawowej,50 jest zwiększony zarówno w tkance maziowej pacjentów, jak i w modelach zwierzęcych z RZS,51-53 głównie na połączeniu panewkowo-chrzęstnym53 , gdzie znajduje się większa liczba komórek produkujących czynnik, w porównaniu z innymi miejscami maziowymi poza tym połączeniem. O znaczeniu czynnika NFkB w kontekście uszkodzenia stawów świadczy nie tylko zwiększona liczba cytokin, ale także osteoklastogeneza – kluczowy proces w erozji kości,54,55 która zależy od linii mieloidalnej i kompleksu RANK-RANKL,56-58 umożliwiającego aktywację, migrację i przeżycie osteoklastu.59,60 RANKL pochodzi z limfocytów T, fibroblastopodobnych synowiocytów i komórek spoza połączenia pancerza z kością.50,61-63 Pettit i wsp. w 2006 roku,64 badali wzór ekspresji RANKL, NF-kB i osteoprotegeryny (naturalny inhibitor RANKL, który blokuje jego wiązanie z receptorem i w ten sposób zapobiega osteogenezie) w próbkach pancerza pacjentów z RZS, a w szczególności w miejscu połączenia pancerza z kością, gdzie nigdy nie było to badane. Okazało się, że zarówno RANKL, jak i osteoprotegeryna ulegają ekspresji w mikrośrodowiskach, w których dochodzi do kontaktu pancerza z kością lub chrząstką oraz do erozji lub uszkodzenia tkanki, zawsze w proporcjach sprzyjających dojrzewaniu osteoklastów i ich aktywacji. Ta molekularna nierównowaga została potwierdzona w 2008 roku.65
Obrazy diagnostyczne i pannus
W 1978 roku Cooperberg jako pierwszy pokazał zapalenie błony maziowej za pomocą ultradźwięków, obserwując pogrubienie błony maziowej kolana na obrazie w skali szarości.66 Dalsze szczegóły zaobserwował De Flaviis w 1988 roku, wdrażając protokół ultrasonograficzny u pacjentów z RZS.67 Minęło 6 lat, aż Newman zastosował metodę Dopplera na ścięgnach i kaletkach maziowych,68 a 2 lata później wykorzystał ją do oceny zgrubień błony maziowej w kolanach pacjentów z RZS.69 Natias Hau w 1999 roku, dysponując ultrasonografią o wysokiej rozdzielczości, po raz pierwszy zastosował tryb Dopplera na panewkach rąk pacjentów z RZS, wykazując hiperwaskularyzację70 stawów kolanowych, potwierdzając tym samym zwiększone unaczynienie opisywane już w badaniach przeprowadzonych sto lat wcześniej (ryc. 14).5,12,14,15
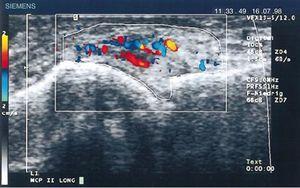
Podłużne badanie ultrasonograficzne stawu śródręczno-paliczkowego przedstawiające pierwsze obrazy dopplerowskie ze zwiększonym unaczynieniem panewki u pacjenta z RZS.70
Po wykazaniu zmian w tkance maziowej za pomocą USG, kolejnym krokiem było ustalenie, czy pannus ten, widoczny klinicznie, również prezentuje inwolucję. Pierwszym, który przeprowadził tego typu badanie ultrasonograficzne był Newman w 1996 r., kiedy to wykorzystał Dopplera w RZS69, zauważając zmiany w ilości unaczynienia po steroidoterapii wewnątrzstawowej. Te same wyniki zaobserwowano w pracy Stone’a z 2001 r.71 Porównał on obrazy stawów śródręczno-paliczkowych, przed i po terapii dożylnym metyloprednizolonem lub doustnym prednizolonem. Stosując inhibitory TNF-a, Hau i wsp. opublikowali w 2002 r. pracę, w której wykazali zmiany w unaczynieniu panewki72 u chorych leczonych etanerceptem, a także w kolejnych badaniach.73-76 Taylor wykazał zmianę hiperwaskularyzacji pod wpływem infliksymabu77 , a Naredo zrobił to samo w 2008 roku.78
Wykorzystanie rezonansu magnetycznego, które rozpoczęło się w 1988 roku od pracy Gilkensona, wykazało, że jest to lepsza metoda wykrywania nadżerek dłoni u chorych na RZS79 ; Kusunoglu w 1990 roku wykazał, że jest ona przydatna w różnicowaniu pogrubienia błony maziowej od wysięku w stawie.80 Wizualizacja pannusa za pomocą tej metody rozpoczęła się w 1994 r., kiedy to Ostergaard po raz pierwszy ocenił rozrost błony maziowej i jego związek z aktywnością choroby,81 potwierdzony szerszą pracą Sugimoto w 1998 r.,82 i wreszcie w 2003 r. grupa OMERACT zdefiniowała synovitis w magnetycznym rezonansie jądrowym jako wzrost grubości błony maziowej po wstrzyknięciu kontrastu; jest to zdecydowanie dowód na istnienie pannusa.83
Wnioski
Historia pozwoliła na zrozumienie krytycznej roli pannusa w destrukcji stawów, który ze względu na szybki i obfity wzrost przypomina niekiedy zmianę nowotworową, sprzyjając produkcji przeciwciał, które utrwalają proces autoimmunologiczny. Przeczy to tezie, że pannus jest mało aktywną tkanką ziarninową, ograniczającą się jedynie do bycia resztkową tkanką bliznowatą. Cechy te zakłócają procesy rozwoju, progresji i destrukcji kości i chrząstki stawowej, które są udowodnione od ponad 100 lat i potwierdzone technikami mikroskopii i biologii molekularnej. Dlatego też pogląd, że pannus jest stanem ostatecznym lub nieodwracalnym jest błędny, ponieważ nie jest on aktywną częścią choroby, a wręcz przeciwnie, może być odwrócony w odpowiedzi na leczenie. Należy unikać nieprawidłowego stosowania tego terminu, aby kliniczna ocena choroby była mniej myląca. Zmiany te były historycznie przypisywane zapaleniu błony maziowej, które jest po prostu stanem zapalnym tkanki maziowej ocenianym klinicznie. Terminu synovitis nie można odróżnić od pannus, ponieważ odnosi się on do wyniku badania histologicznego, dlatego też pannus nie jest uwzględniany ani we wstępnej ocenie klinicznej, ani w badaniach kontrolnych pacjentów z RZS prowadzonych przez różne towarzystwa naukowe.
Dalsze badania nad pannusem jako nieodzownym elementem patogenezy RZS przyczynią się do lepszego zrozumienia choroby od samego jej początku i otworzą nowe ścieżki jej oceny klinicznej lub obrazowej, a także pozwolą na identyfikację bardziej ukierunkowanych terapii hamujących destrukcję stawów.
Konflikt interesów
Autorzy nie mają konfliktu interesów do ujawnienia.
Autorzy nie mają konfliktu interesów do ujawnienia.