Korozja jest naturalnie niszczącym zjawiskiem, które występuje, gdy niektóre metale są wystawione na działanie środowiska. Reakcja pomiędzy powietrzem, wilgocią i podłożem metalowym wywołuje specyficzne reakcje chemiczne, które powodują przekształcenie metalu w jego bardziej stabilną chemicznie formę tlenku, wodorotlenku lub siarczku. W metalach na bazie żelaza, takich jak stal, korozja występuje w postaci tlenków żelaza III, znanych również jako rdza.
Aby wystąpiła korozja elektrochemiczna, muszą być obecne trzy składniki: anoda, katoda i elektrolit. Anoda i katoda są zwykle połączone ciągłą ścieżką elektryczną, podczas gdy obie są zanurzone w tym samym elektrolicie. Podczas tego procesu anoda ulega korozji, podczas gdy katoda pozostaje nienaruszona.

Rysunek 1. Typowe ogniwo elektrochemiczne przedstawiające elektrony przepływające od anody do katody poprzez połączenie elektryczne. (Źródło: Alksub at the English Wikipedia / CC BY-SA)
Istnieją różne metody zapobiegania i kontroli korozji. Jedna z nich znana jest jako ochrona katodowa (CP). Technika ta działa poprzez połączenie metalu, który ma być chroniony, z łatwiej korodującym „metalem ofiarnym”. Ten metal ofiarny koroduje preferencyjnie (działając jako anoda), podczas gdy bardziej wartościowy obiekt metalowy (działający jako katoda) pozostaje chroniony. W tym artykule wyjaśnimy, jak działa ta metoda ochrony ofiarnej i opiszemy jej różne zastosowania.
Zrozumienie korozji galwanicznej lub bimetalicznej
Aby zrozumieć, jak działa ochrona katodowa, musimy najpierw docenić podstawy korozji bimetalicznej, znanej również jako korozja galwaniczna. Korozja bimetaliczna, jak sama nazwa wskazuje, jest unikalnym rodzajem korozji, która występuje pomiędzy parą dwóch metali. Korozja ta jest obserwowana w kilku sytuacjach, w których metale niepodobne są w bezpośrednim lub pośrednim kontakcie ze sobą. Korozja bimetaliczna charakteryzuje się zwykle przyspieszoną korozją w jednym metalu, podczas gdy drugi pozostaje nienaruszony. Innymi słowy, jeden metal poświęca się, chroniąc jednocześnie drugi. (Proces ten jest dokładniej opisany w artykule Why Do Two Dissimilar Metals Cause Corrosion?)
Korozja w ogniwie elektrochemicznym jest napędzana głównie przez właściwość znaną jako różnica potencjałów. Ta różnica potencjałów powoduje przepływ elektronów z jednego metalu w ogniwie (anody) do drugiego (katody), generując przy tym niewielką ilość energii elektrycznej. Gdy elektrony wypływają z anody, następuje utlenianie, powodując degradację lub korozję metalu anodowego. Tymczasem, gdy elektrony przepływają do katody, następuje redukcja, co dodatkowo chroni metal katodowy.
W korozji bimetalicznej ta różnica potencjałów jest bezpośrednim wynikiem różnicy potencjałów elektrod między dwoma niepodobnymi metalami. Kiedy metal jest zanurzony w elektrolicie, przyjmuje potencjał elektrody, który reprezentuje zdolność metalu do bycia utlenionym lub zredukowanym. Potencjał elektrodowy różnych metali jest przedstawiony na liście znanej jako szereg galwaniczny. (Zobacz Wprowadzenie do serii galwanicznej: Galvanic Compatibility and Corrosion, aby uzyskać więcej informacji). Metale znajdujące się wyżej w tabeli są uważane za anodowe (bardziej elektroujemne), podczas gdy metale znajdujące się niżej w tabeli są bardziej katodowe (bardziej elektroujemne). Im dalej od siebie znajdują się stykające się metale w szeregu galwanicznym, tym większa jest różnica potencjałów między metalami, a więc tym poważniejsza jest korozja na anodzie.
Ochrona katodowa (CP) i jej metoda działania
Pomimo że konstrukcja systemów ochrony katodowej może być skomplikowana, ich działanie opiera się na koncepcji korozji bimetalicznej lub galwanicznej opisanej wcześniej. Rozumiejąc zasady działania tego typu korozji, możemy celowo łączyć metale w pary, aby zapewnić, że jeden z nich będzie chronił drugi. Innymi słowy, jeśli chcemy chronić konkretną strukturę metaliczną, możemy stworzyć warunki, w których ten metal stanie się katodą ogniwa elektrochemicznego. Poprzez elektryczne połączenie metalu, który ma być chroniony z bardziej anodowym (elektronegatywnym) metalem, możemy zapewnić, że anoda poświęci się, korodując preferencyjnie w stosunku do swojego katodowego odpowiednika.
W niektórych przypadkach, zewnętrzne źródła energii mogą być wykorzystane do dostarczenia dodatkowych elektronów do procesu elektrochemicznego, co może zwiększyć skuteczność ochrony katodowej.
Systemy ochrony katodowej są stosowane w wielu gałęziach przemysłu do ochrony szerokiego zakresu struktur w trudnych lub agresywnych środowiskach. Przemysł naftowy i gazowy, w szczególności, wykorzystuje systemy ochrony katodowej do zapobiegania korozji w rurociągach paliwowych, stalowych zbiornikach magazynowych, platformach morskich i obudowach szybów naftowych. W przemyśle morskim, ta metoda ochrony jest również stosowana na stalowych palach, pomostach, pirsach i kadłubach statków. Inny popularny rodzaj ochrony katodowej, znany jako cynkowanie, jest powszechnie stosowany do ochrony elementów i konstrukcji stalowych. (Aby dowiedzieć się więcej, przeczytaj Galwanizacja i jej skuteczność w zapobieganiu korozji.)
Typy ochrony katodowej (CP)
Jak wspomniano wcześniej, ochrona katodowa działa poprzez celowe tworzenie ogniwa galwanicznego z innym metalem ofiarnym. Można to osiągnąć stosując dwa różne rodzaje ochrony katodowej: pasywną ochronę katodową i ochronę katodową prądem imponującym.
Pasywna ochrona katodowa
W systemach pasywnej ochrony katodowej, anoda protektorowa jest podłączona bezpośrednio lub pośrednio do metalu, który ma być chroniony. Różnica potencjałów pomiędzy dwoma niepodobnymi metalami generuje odpowiednią ilość energii elektrycznej, aby utworzyć ogniwo elektrochemiczne i napędzać korozję galwaniczną lub bimetaliczną.
Ten rodzaj ochrony jest powszechnie stosowany w przemyśle naftowym i gazowym do ochrony stalowych elementów konstrukcyjnych platform i platform morskich. W tym przypadku pręty aluminiowe (lub inny odpowiedni metal) są montowane bezpośrednio na sekcjach stalowych, aby przyjąć rolę metalu ofiarnego. Stalowe podgrzewacze wody, zbiorniki i pale są również chronione katodowo przy użyciu podobnej metody.
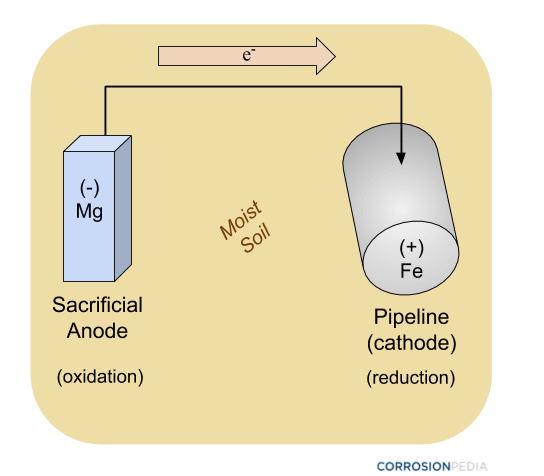
Rysunek 2. Schemat rurociągu chronionego anodą protektorową przy użyciu pasywnych metod ochrony katodowej. Zauważ, że nie ma zewnętrznego źródła zasilania.
Innym powszechnym przykładem pasywnej ochrony katodowej jest cynkowanie ogniowe stali. Podczas tego procesu, stalowe elementy lub konstrukcje są zanurzane w kąpieli z roztopionego cynku, który pokrywa obiekt. Kiedy stal jest usuwana z roztopionego cynku, reaguje z powietrzem i wilgocią, tworząc warstwę ochronną znaną jako węglan cynku, który tworzy ogniwo galwaniczne ze stalą.
Gdy element stalowy jest porysowany lub uszkodzony, tak że podłoże jest odsłonięte, otaczająca go powłoka cynkowa działa jak anoda protektorowa i koroduje preferencyjnie, chroniąc odsłoniętą stal. Ten rodzaj ochrony trwa do momentu wyczerpania się pobliskiego cynku.
Impressed current cathodic protection (ICCP)
W dużych konstrukcjach zastosowanie pasywnych metod ochrony katodowej może być niewykonalne. Liczba anod protektorowych wymaganych do dostarczenia wystarczającego prądu do zapewnienia odpowiedniej ochrony może być nierealistyczna lub niepraktyczna. Aby temu zaradzić, stosuje się zewnętrzne źródło energii, które wspomaga reakcje elektrochemiczne. Technika ta znana jest jako ochrona katodowa prądem imponującym (ICCP). Systemy ICCP są idealne do ochrony długich konstrukcji, takich jak podziemne rurociągi. Kołnierze rur łączących są zwykle izolowane przy użyciu zestawów izolacyjnych, aby rozdzielić rury na mniejsze, bardziej poręczne sekcje do celów ochrony ICCP.

Rysunek 3. Schemat obiektu chronionego przez anodę z wykorzystaniem metod ochrony katodowej prądem imponującym (ICCP). Zwróć uwagę, jak zaangażowane jest zewnętrzne źródło prądu stałego.
Ograniczenia ochrony katodowej
W dużych sieciach rurociągów może występować wiele skrzyżowań, równoległości i podejść w pobliżu systemu CP rurociągu. Między rurociągami mogą wystąpić zakłócenia prądu stałego, co przyspiesza korozję. W celu przezwyciężenia tego problemu rurociągi można połączyć elektrycznie, bezpośrednio lub przez opór.
W przypadku rurociągów powlekanych może wystąpić dysbondaż katodowy ze względu na wysokie poziomy CP, gdy jakość zastosowanej powłoki jest niska. Wyższe temperatury również mogą sprzyjać dyskondycji katodowej. Środowiska o wysokim pH również stanowią problem w kontekście pękania korozyjnego pod wpływem naprężeń.
Wniosek
Ochrona katodowa jest popularną metodą ochrony przed korozją rurociągów, morskich platform wiertniczych i innych konstrukcji stalowych. Jednakże, aby mogła być skutecznie wdrożona, konieczne jest zrozumienie podstawowych zasad korozji bimetalicznej/galwanicznej. Wybór odpowiedniego typu systemu ochrony katodowej zależy od kilku czynników, w tym od opłacalności i wielkości chronionej konstrukcji.