Struktura Lewisa dla jonu węglanowego jest rysowana w tym tutorialu krok po kroku. Całkowita koncepcja elektronów walencyjnych jest używana do rysowania struktury Lewisa dla CO32-. Po zakończeniu rysowania struktury Lewisa jonu CO32-, powinien on posiadać ładunek -2 i stabilność. O tych rzeczach dowiesz się w tym przewodniku.
Jon węglanowy | CO32-
Jon węglanowy ma ładunek -2. Związki węglanowe metali są powszechne na świecie. Jako przykład można podać CaCO3.
CO32- struktura Lewisa
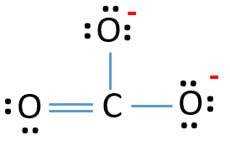
W strukturze Lewisa jonu CO32- występują trzy wiązania σ i wiązanie π wokół atomu węgla.
Kroki rysowania struktury Lewisa jonu CO32-
Następujące kroki są wymagane do narysowania struktury Lewisa jonu CO32- i są one szczegółowo wyjaśnione w tym poradniku.
- Znajdź całkowitą liczbę elektronów w powłokach walencyjnych atomów węgla i tlenu
- Całkowita liczba par elektronów
- Wybierz atom centralny
- Załóż samotne pary na atomy
- Sprawdź stabilność i zminimalizuj ładunki na atomach poprzez zamianę samotnych par na wiązania.
Narysowanie poprawnej struktury Lewisa jest ważne, aby poprawnie narysować struktury rezonansowe CO32-.
Całkowita liczba elektronów powłok walencyjnych CO32-
Węgiel znajduje się w grupie 4 w układzie okresowym. Tak więc, węgiel ma cztery elektrony w swojej powłoce walencyjnej.Tlen znajduje się na 6 grupie. Ma sześć elektronów w powłoce walencyjnej.
- Całkowita liczba elektronów walencyjnych atomu węgla = 4
W jonie CO32- znajdują się trzy atomy tlenu, Dlatego
- Całkowita liczba elektronów walencyjnych atomów tlenu = 6 *3 = 18
Jon CO32- ma ładunek -2. Dlatego są dwa elektrony więcej, które przyczyniają się do elektronów walencyjnych.
- Ogólna liczba elektronów walencyjnych = 4 + 18 + 2 = 24
Ogólna liczba par elektronów walencyjnych
Ogólna liczba par elektronów walencyjnych = σ wiązania + π wiązania + samotne pary w powłokach walencyjnych
Ogólna liczba par elektronów walencyjnych jest określana przez podzielenie liczby elektronów walencyjnych przez dwa. Dla jonu CO32-, całkowita liczba par elektronowych wynosi 12.
Centralny atom jonu CO32-
Aby być atomem centralnym, ważna jest umiejętność posiadania wyższej wartościowości. Węgiel ma większe szanse na bycie atomem centralnym (patrz rysunek), ponieważ węgiel może mieć walencyjność 4. Najwyższa walencyjność tlenu to 2. Tak więc teraz możemy zbudować szkic jonu CO32-.
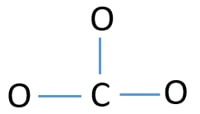
Samotne pary na atomach
- W powyższym szkicu są już trzy wiązania C-O. Pozostaje zatem tylko dziewięć (12-3 = 9) par elektronów walencyjnych.
- Najpierw zaznacz te dziewięć par elektronów walencyjnych jako samotne pary na zewnętrznych atomach (na atomach tlenu). Jeden atom tlenu weźmie trzy samotne pary zgodnie z regułą oktalową (atom tlenu nie może zachować więcej niż osiem elektronów w swojej powłoce walencyjnej).
- Dla trzech atomów tlenu, dziewięć par elektronów jest spędzony. Teraz nie ma więcej samotnych par do zaznaczenia na atomach węgla po zaznaczeniu na atomach tlenu (poza atomami).
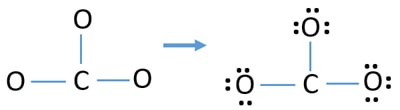
Ładunki na atomach
Po zaznaczeniu par elektronowych na atomach, powinniśmy zaznaczyć ładunki każdego atomu. Zaznaczanie ładunków jest istotne, ponieważ służy do wyznaczenia najlepszej struktury lewisa dla danego jonu. Po zaznaczeniu ładunków, zobaczysz, że każdy atom tlenu otrzyma ładunek -1, a atom węgla +1.
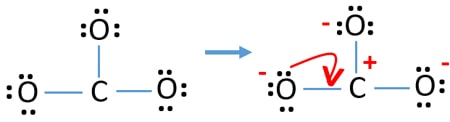
Sprawdź stabilność i zminimalizuj ładunki na atomach poprzez zamianę samotnych par na wiązania
- Atomy tlenu powinny posiadać ładunki ujemne, ponieważ elektronegatywność atomu tlenu jest wyższa niż atomu węgla. Inaczej możemy powiedzieć, że zdolność do utrzymywania ładunków ujemnych jest większa w atomach tlenu niż w atomach węgla.
- Narysowana struktura nie jest stabilna, ponieważ wszystkie atomy posiadają ładunek (struktura Lewisa powinna być stabilna z mniejszą ilością ładunków).
- Teraz powinniśmy spróbować zminimalizować ładunki poprzez zamianę samotnej pary lub par na wiązania. Więc przekonwertować jedną samotną parę jednego atomu tlenu, aby wiązanie C-O.
- Teraz mamy podwójne wiązanie pomiędzy atomem węgla i jednym atomem tlenu (jedno wiązanie C=O). Teraz istnieją dwa pojedyncze wiązania między atomem węgla i dwoma innymi atomami tlenu (dwa wiązania C-O).
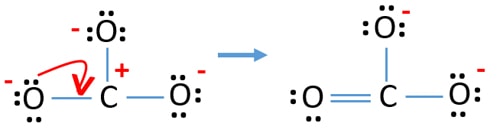
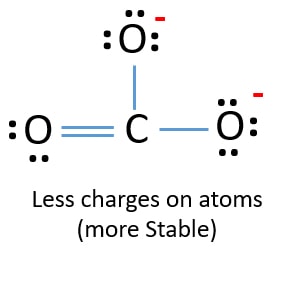
W nowej strukturze, ładunki atomów są zmniejszone niż w poprzedniej strukturze. Teraz nie ma ładunków na jednym atomie tlenu i atomie węgla. Również tylko dwa atomy tlenu mają -1 ładunek ujemny. Teraz rozumiesz, że ta struktura CO32- jest bardziej stabilna niż poprzednia struktura. Tak więc, ta struktura ma większe szanse być struktura lewisa jonu CO32-.
Struktura Lewisa jonu CO32- (węglanowego)
Pytania
Zadaj pytanie z chemii i znajdź odpowiedź
struktura Lewisa węglanowego i struktura Lewisa wodorowęglanowego
W jonie węglanowym, znajdują się dwa atomy tlenu, które mają ładunek -1 na każdym z nich. Jeden z tych atomów tlenu przyjmuje proton (jon H+) i tworzy grupę -OH.
Powiązane samouczki
.