XeF2 to skrót od nazwy związku chemicznego difluorek ksenonu. Jest on silnym czynnikiem fluoryzującym, jak również utleniającym. Oprócz XeF2 istnieją inne związki ksenonu, takie jak XeF4 (tetrafluorek ksenonu) i XeF6 (heksafluorek ksenonu). Z tych związków, XeF2 jest najbardziej stabilny jeden. Jest to białe
krystaliczne ciało stałe używane do celów fluoryzacji w procedurach elektrochemicznych i laboratoriach. XeF2 ma typowy mdlący zapach i ulega rozkładowi w kontakcie z parą wodną lub światłem.
Ważne jest, aby znać jego strukturę Lewisa, hybrydyzację i polarność, aby zrozumieć właściwości chemiczne, jak również geometrię molekularną związku. Więc teraz zrozummy wszystkie właściwości szczegółowo.
Zawartość
Xef2 Struktura Lewisa
Struktura Lewisa danego związku chemicznego jest kluczowa dla poznania wszystkich właściwości fizycznych i właściwości chemicznych. Jest ona obrazowym przedstawieniem wszystkich elektronów uczestniczących w tworzeniu wiązań. Struktura ta pomaga w zrozumieniu ładunków na cząsteczkach związku. Elektrony, które biorą udział w tworzeniu wiązań, jak również te, które w nich nie uczestniczą, nazywane są wspólnie elektronami walencyjnymi.
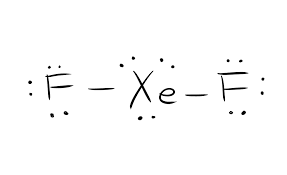
Elektrony, które biorą udział w tworzeniu wiązań nazywane są parami elektronów wiążących. Te, które nie biorą udziału w tworzeniu wiązań nazywamy samotną parą elektronów. Dla rozróżnienia pomiędzy różnymi typami elektronów, zarówno wiążące jak i samotne pary elektronów są przedstawiane w różny sposób. Formacja wiązania w związku jest przedstawiona jako linie proste, a samotne pary są przedstawione jako kropki.
Struktura Lewisa jest oparta na regule oktetu. Reguła ta mówi, że każda cząsteczka powinna mieć osiem elektronów w zewnętrznej powłoce atomu, aby była stabilna. Jeśli jest więcej elektronów niż to, to związek oddaje elektron. Natomiast jeśli jest ich mniej niż osiem, związek przyjmuje elektrony od innej cząsteczki, aby być stabilnym.
Więc dla tego związku XeF2, jest jedna cząsteczka ksenonu i dwie cząsteczki fluoru. Pojedyncza cząsteczka ksenonu ma osiem elektronów, a cząsteczka fluoru ma siedem elektronów walencyjnych.
Całkowita liczba elektronów walencyjnych = Liczba elektronów walencyjnych dla ksenonu + Liczba elektronów walencyjnych dla fluoru. elektronów walencyjnych dla fluoru
=8+ 7*2
=8+14
=22
Całkowita liczba elektronów walencyjnych dla XeF2=22.
Hybrydyzacja Xef2

Hybrydyzacja danej cząsteczki jest niezbędna do zrozumienia jej geometrii. Podczas tworzenia wiązania, dwa lub więcej orbitale o różnych poziomach energetycznych łączą się i tworzą orbitale hybrydowe. W XeF2, zewnętrzna powłoka ksenonu ma osiem elektronów, z których dwa elektrony biorą udział w tworzeniu wiązań.
Stan podstawowy ksenonu ma 8 elektronów ułożonych w orbitalach s2 p6. Natomiast w XeF2, cząsteczka Xe ma stan wzbudzony. Układ elektronów w ksenonie zmienia się na s2 p5 d1 z dwoma niesparowanymi elektronami. Stąd hybrydyzacja centralnego atomu Xe jest sp3d. Stąd hybrydyzacja cząsteczki XeF2 jest sp3d.
Geometria molekularna Xef2

Ogólnie, struktura Lewisa jest pomocna w zrozumieniu geometrii molekularnej dowolnego związku chemicznego. Ponieważ jednak ksenon nie tworzy łatwo wiązań, związek ten jest przypadkiem wyjątkowym. Geometria molekularna difluorku ksenonu może być zrozumiana dzięki znajomości teorii VSEPR. Teoria ta opiera się na liczbie sterycznej atomu centralnego i elektronów walencyjnych związku. VSEPR jest skrótem od Valence Shell Electron Pair Repulsion theory.
W tym przypadku liczba steryczna dla centralnego atomu ksenonu wynosi 5. Oznacza to, że pojedyncza cząsteczka ksenonu może tworzyć wiązania z pięcioma cząsteczkami. Ale tutaj, w XeF2, tworzy on wiązania tylko z dwoma atomami fluoru. W przypadku ksenonu, dwa elektrony z ośmiu tworzą wiązania z atomami fluoru. Te sześć elektronów jest teraz elektronami niewiążącymi. Te trzy samotne pary elektronów rozprzestrzeniają się w układzie, który jest na pozycji równikowej do związanych par elektronów.
Kształt cząsteczki powinien być trygonalną dwupiramidą jak na hybrydyzację, ale tak nie jest. XeF2 jest cząsteczką liniową ze względu na rozmieszczenie atomów fluoru i samotnych par elektronów w układzie symetrycznym.
Kąt wiązania
Gdy znamy już geometrię cząsteczki difluorku ksenonu, kąt wiązania może być łatwo zrozumiany. Istnieją dwie pary elektronów związanych i trzy samotne pary elektronów. Samotne pary znajdują się w pozycji równikowej do par związanych. Kąt wiązania pomiędzy dwiema parami związanymi z atomem centralnym wynosi 180 stopni, co sprawia, że geometria cząsteczki XeF2 jest liniowa.
Polaryzacja Xef2
![]()
Polaryzacja każdej cząsteczki zależy od geometrii molekularnej i hybrydyzacji związku. W cząsteczce XeF2 dwa atomy fluoru są rozmieszczone symetrycznie na zewnątrz, a centralny atom ksenonu znajduje się w środku. Ze względu na symetryczne rozmieszczenie elektronów walencyjnych w związku nie występuje moment dipolowy netto. Stąd difluorek ksenonu jest niepolarny, gdyż w cząsteczce nie obserwuje się polarności.
Uwagi końcowe
Podsumowując artykuł można stwierdzić, że XeF2 posiada 22 elektrony walencyjne, z czego są trzy samotne pary elektronów. Jego hybrydyzacja jest sp3d. Zgodnie z teorią VSEPR, geometria cząsteczki jest liniowa. Kąt wiązania F-Xe-F wynosi 180 stopni. Ponieważ po obu stronach atomu centralnego znajdują się cząsteczki fluoru, nie występuje moment dipolowy, a więc nie ma polarności. XeF2 jest niepolarny ze względu na symetryczne rozmieszczenie par elektronów w wiązaniu.