Abstract
Background
Diagnostyka ostrego zawału serca (AMI) jest obecnie potwierdzana przez oznaczenie osoczowej troponiny I (pTi). W oparciu o wcześniejsze doniesienia, że płytki krwi pochodzące od osób z AMI agregowane przez różne czynniki agregujące nie mogą być hamowane przez kwas acetylosalicylowy (aspirynę), zbadano możliwość rozpoznania AMI.
Metody
W badaniu wzięli udział pacjenci w wieku 40-60 lat z AMI (n=50, M=35, F=15) lub ACS (n=30, M=20, F=10) oraz taka sama liczba normalnych ochotników dobranych pod względem wieku i płci. Hamowanie przez 80 µM aspiryny agregacji płytek krwi wywołanej przez 2,0 µM ADP badano poprzez inkubację osocza bogatopłytkowego (PRP) z tym związkiem przez 30 min w temp. 37°C, a agregację przeprowadzano w agregometrze optycznym.
Wyniki
W przypadku prawidłowego PRP, hamowanie przez aspirynę wynosiło ≈100%. W przypadku ACS, procent zahamowania wynosił 63,2% w porównaniu do przypadków AMI, gdzie nie stwierdzono żadnego zahamowania (tj. 0% zahamowania, p<0,001) przez aspirynę w agregacji płytek indukowanej ADP (czułość= 92% i swoistość=100%).
Wniosek
Możliwe było zdiagnozowanie wystąpienia AMI na podstawie braku hamującego wpływu aspiryny na agregację płytek krwi.
Słowa kluczowe
agregacja płytek krwi, diagnostyka zawału serca, troponina, aspiryna.
Wprowadzenie
Agregacja płytek krwi przez różne czynniki agregujące płytki, w tym ADP, l-efinefrynę, kolagen lub trombinę jest znana jako niezbędna w ratującym życie procesie krzepnięcia krwi. Z drugiej strony, nadmierna agregacja płytek krwi w miejscu pęknięcia blaszki miażdżycowej na ścianie tętnicy wieńcowej prowadzi do rozwoju skrzepliny, mikroagregatu płytek krwi, który może czasami prowadzić do zablokowania normalnego krążenia krwi w mięśniu sercowym, co w konsekwencji może prowadzić do ostrego zespołu wieńcowego (ACS). Chociaż agregacja płytek krwi w miejscu pęknięcia blaszki miażdżycowej może rozwinąć się w ACS, agregacja płytek krwi, czasami może również zablokować tętnicę osierdziową, co może spowodować śmierć komórek serca, które pojawiły się jako ciemne obszary zawałów rozwiniętych z powodu śmierci komórek serca, które ostatecznie może prowadzić do ostrego zawału serca (AMI), które, gdy masywne, może spowodować śmierć ofiar. Zawały transmuralne w zależności od stopnia uszkodzenia mięśnia sercowego, które mogą, ale nie zawsze muszą być wyrażone jako nieprawidłowe załamki Q, ale mogą być również zaangażowane w pojawienie się nieprawidłowych załamków ST i T w 50% przypadków w EKG, co skutkuje zawałem mięśnia sercowego z uniesieniem odcinka ST (STEMI) lub bez uniesienia odcinka ST (non-STEMI), i jako takie, EKG może nie być diagnostycznie przydatne do określenia wystąpienia AMI. Chociaż ból w klatce piersiowej jest zazwyczaj silny i trwa dłużej niż w przypadku ACS, wiadomo, że sam ból ma charakter subiektywny i może być zdarzeniem symulowanym, innym niż sam AMI. I jako takie, rozpoznanie AMI jest zwykle potwierdzane przez oznaczenie troponiny I (pTi) w osoczu metodą ELISA (Enzyme Linked Immuno Sorbent Assay) z użyciem przeciwciała troponiny I.
Jednakże zarówno troponina I (Ti) jak i jej przeciwciało są drogie, a ponadto sama metoda ELISA nie zawsze może być wystarczająco szybka, aby potwierdzić wystąpienie AMI w wymagającej sytuacji, która może być potrzebna do ewentualnej interwencji terapeutycznej w tym stanie. Z tych powodów diagnostyka laboratoryjna AMI nie jest dostępna, niekoniecznie z wyboru, w wielu częściach świata.
Ostatnio donosiliśmy, że osocze bogatopłytkowe (PRP) od pacjentów z AMI preinkubowane z 80 µM kwasem acetylosalicylowym (aspiryną), przez 30 min w 37°C nie hamowało agregacji płytek krwi inicjowanej przez różne czynniki agregacji płytek, w tym ADP, w porównaniu z normalnym PRP lub PRP z ACS. Na podstawie tych wstępnych badań zbadaliśmy możliwość potwierdzenia wystąpienia AMI za pomocą agregometrii optycznej, nawet przy braku oznaczenia pTi.
Opisujemy tutaj możliwość potwierdzenia wystąpienia AMI w odróżnieniu od wystąpienia ACS poprzez oznaczenie indukowanego aspiryną hamowania agregacji płytek krwi indukowanej przez ADP za pomocą agregometru. Wystąpienie AMI potwierdzano równoległym i jednoczesnym oznaczaniem pTi metodą ELISA.
Metody i materiały
Ozwolnienie etyczne
Projekt badawczy ”Laboratoryjna diagnostyka ostrego zawału mięśnia sercowego za pomocą agregometrii optycznej płytek krwi” wymagał pobrania nominalnej ilości krwi (2 mL) od pacjentów z AMI lub ACS oraz od normalnych ochotników. The Institutional Review Board, Human & Animal Research Ethics Committee, Sinha Institute Of Medical Science And Technology, Kolkata, India zatwierdziła badanie pod warunkiem, że postępowano zgodnie z zatwierdzonym protokołem etycznym dla ludzi, ściśle według Deklaracji Helsińskiej z 1964 roku i żadne odchylenie w badaniu nie było dozwolone bez uprzedniej pisemnej zgody zarządu. Wszyscy uczestnicy byli w wieku od 40-60 lat. W badaniu nie uczestniczyli upośledzeni umysłowo, kobiety w ciąży ani więźniowie. Przed przystąpieniem do badania wszyscy ochotnicy podpisali formularz świadomej zgody na udział w badaniu. W przypadku osób z ACS lub AMI zgodę na udział w badaniu uzyskiwano również od krewnych pacjenta poprzez podpisanie oświadczenia sądowego. Lekarze prowadzący decydowali, czy próbka krwi (2 ml) może być pobrana od pacjenta bez narażania go na niebezpieczeństwo. Krew pobierana była przez lekarza prowadzącego lub przez licencjonowaną pielęgniarkę. Upewniono się, że ochotnicy nie mają innych infekcji zagrażających życiu. Komitet rutynowo kontrolował postępy i problemy obecnego badania.
Chemikalia
Kozia anty-rabbitowa immunoglobulina G – fosfataza alkaliczna i ADP zostały uzyskane z Sigma Aldrich. Enzyme Linked Immunosorbent Assay (ELISA) maxisorp plates were from Nunc, Rosaklide, Denmark. Troponina I, przeciwciało Troponina I, CK-MB, przeciwciało CK-MB otrzymano z firmy Abcam. Kwas acetylosalicylowy (aspiryna) otrzymano z firmy Medica Zydus Healthcare. Wszystkie inne użyte substancje chemiczne były klasy analitycznej.
Wybór pacjentów z AMI
W badaniu wzięło udział łącznie 50 pacjentów (n=50, M=35, F=15, w wieku 40-60 lat z bólem w klatce piersiowej, który trwał >120h. Badani zostali przyjęci na oddział intensywnej terapii w Calcutta Medical College and Hospital. Pacjenci z cukrzycą lub infekcją zagrażającą życiu nie byli włączeni do badania. Ponieważ zapalenie osierdzia, zatorowość płucna, zaburzenia aortalne i jelitowe są znane jako czynniki stymulujące ból w klatce piersiowej z powodu AMI lub ACS, pacjenci z tymi warunkami zostali starannie wykluczeni z badania. Wszyscy uczestnicy, którzy byli hospitalizowani z jakimkolwiek schorzeniem w ciągu ostatnich sześciu miesięcy lub pacjenci, którzy otrzymali aspirynę w ciągu 2 tygodni zostali wykluczeni z badania.
Wybór normalnych ochotników
Do badania włączono również równą liczbę dopasowanych pod względem wieku i płci normalnych ochotników. Żaden z normalnych ochotników nie miał cukrzycy ani historii nadciśnienia systemowego przy prezentacji. Żaden z normalnych ochotników nie miał żadnej zagrażającej życiu infekcji ani nie był hospitalizowany z powodu jakiegokolwiek stanu w ciągu ostatnich sześciu miesięcy. Żadna z ochotniczek nie otrzymywała nigdy żadnych leków antykoncepcyjnych. Żadna z ochotniczek nie przyjmowała aspiryny ani żadnych leków nasercowych w ciągu ostatnich 4 tygodni.
Diagnoza AMI
Wszyscy pacjenci z AMI zostali przyjęci na oddział intensywnej opieki kardiologicznej w szpitalu z charakterystycznym bólem w klatce piersiowej, jak opisano powyżej. Do badania włączono pacjentów z AMI zarówno ze STEMI, jak i bez STEMI. U wszystkich wyselekcjonowanych chorych obserwowano rozwijające się załamki Q w zapisie EKG. W przypadkach, w których nie można było jednoznacznie wykazać występowania załamków Q w EKG, zostali oni wykluczeni z badania. Wystąpienie AMI potwierdzono oznaczając poziom pTi metodą ELISA.
Diagnozowanie ACS
W ramach zamierzonego badania do badania włączono 30 pacjentów (n=30, M=20, F=20) w wieku 40-60 lat. Pacjenci ci mieli charakterystyczny ból w klatce piersiowej. Z badania wykluczono chorych, u których występował blok odnogi pęczka Hisa, a w EKG nie można było ustalić rejonów niedokrwienia serca.
Występowanie OZW potwierdzano oznaczeniem CK-MB w próbce krwi poprzez pobranie próbki w ciągu 6h od przyjęcia do szpitala.
Próbki krwi zarówno w przypadku AMI jak i ACS zostały uzyskane od badanych przed rozpoczęciem jakiejkolwiek terapii kardiologicznej w celu zminimalizowania niejednoznaczności.
Protokół badania
Wybrani pacjenci zostali poddani randomizacji, a każdej próbce krwi z AMI, ACS i od zwykłych ochotników przypisano arbitralny numer i przechowywano ją pod nadzorem pracownika biurowego, który nie był badaczem. Badacz nie miał wiedzy, czy pobrana próbka krwi pochodziła z AMI lub ACS, czy od normalnego ochotnika. Dopiero po zakończeniu badania „klucz” do informacji dotyczących stanu uczestnika był dostępny dla badaczy w celu przeprowadzenia analiz statystycznych. Wszystkie próbki krwi badano tak szybko, jak to było praktycznie możliwe po wycofaniu próbki.
Przygotowanie osocza bogatopłytkowego (PRP)
Preparat PRP od uczestników badania przygotowano przez odwirowanie, jak opisano wcześniej .
Osocze bezpłytkowe (PFP) użyte do oznaczenia CK-MB lub pTi przygotowano przez odwirowanie próbek krwi przy 10 000 g w temperaturze 0°C .
Zahamowanie agregacji płytek krwi przez aspirynę
Typowo, PRP od osób z AMI, ACS lub od normalnych ochotników inkubowano z 80 µM aspiryny przez 30 min w 37°C. Agregacja płytek była inicjowana przez traktowanie PRP z 2 µM ADP preinkubowanym z lub bez aspiryny. W eksperymentach kontrolnych PRP traktowano równą objętością 0,9% NaCl inkubowanego w 37°C przez 30 min.
Przygotowanie roztworu aspiryny
Świeżo przygotowany roztwór aspiryny sporządzano przez rozpuszczenie aspiryny w wodzie dejonizowanej, a pH utrzymywano na poziomie 7,0 przez dodanie 0,1M NaHCO3. Roztwór aspiryny wyrzucano po użyciu.
Oznaczenie stężenia troponiny I i CK-MB w osoczu
Poziomy pTi i CK-MB oznaczano metodą ELISA przy użyciu przeciwciała Troponina I i przeciwciała CK-MB.
Analiza statystyczna
Otrzymane wyniki przedstawiono jako +/- odchylenie standardowe, natomiast istotność wyników określono za pomocą testu t-Studenta. Wartości p<0,05 uznano za istotne. W stosownych przypadkach określono również współczynniki korelacji Pearsona ® wyników. Wynik Pearsona „r”, jest taki, że -1 ≤ r ≤ +1 jest dopuszczalny, gdzie znaki (+) i (-) oznaczają odpowiednio dodatnie korelacje liniowe i ujemne korelacje liniowe. Do analiz statystycznych wykorzystano oprogramowanie Graph Pad Prism (Graph Pad Software, San Diego, USA) oraz Micro Cal origin 6.0. Ocenę testów diagnostycznych oraz analizę krzywej ROC (Receiver Operator Curve) przeprowadzono przy użyciu oprogramowania statystycznego MedCalc, Belgia. Zgodnie z analizą ROC test o doskonałej dyskryminacji (brak nakładania się dwóch rozkładów) ma krzywą ROC przechodzącą przez lewy górny róg (100% czułości, 100% swoistości). Dlatego im bliżej lewego górnego rogu znajduje się krzywa ROC, tym wyższa jest ogólna dokładność testu. Obszar pod krzywą (AUC) został określony ilościowo, co jest miarą tego, jak dobrze dany parametr może rozróżnić dwie grupy diagnostyczne (chory/normalny).
Wyniki
Wpływ aspiryny na hamowanie agregacji płytek krwi indukowanej przez ADP w PRP od osób z ACS, AMI i od normalnych ochotników
Gdy PRP od tych osób inkubowano z 80 µM aspiryny przez 30 min w 37°C i inicjowano agregację płytek krwi przez potraktowanie PRP 2.0µM ADP, stwierdzono, że tylko w przypadku PRP od osób z AMI związek ten nie hamował (0% inhibicji) agregacji płytek. Natomiast w przypadku ACS (procent inhibicji w zakresie 52%-68%) lub w przypadku prawidłowego PRP płytki były hamowane w 100% (Rycina 1, Panel A). Analiza krzywej operatora odbiornika (ROC) wykazała 92% czułość (95% przedział ufności (CI): 91,0-100,0) i 100% swoistość (95% CI: 91,0-100,0, P<0,0001). Obszar pod krzywą (AUC) badany za pomocą analizy ROC wynosił 0,952 (Figura 1, panel B).
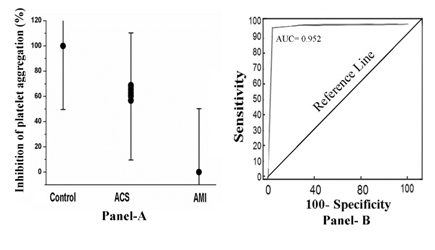
Figura 1. Procentowe hamowanie agregacji płytek i analiza krzywej operatora odbiornika w PRP przez aspirynę w przypadku normalnych, ACS i AMI przedmiotów. Panel A: PRP od osób z normalnym, ACS i AMI przygotowano zgodnie z opisem w Materiałach i Metodach i inkubowano z 80 µM aspiryny przez 30 min w temperaturze 37 ° C. Po inkubacji agregacja płytek krwi została zainicjowana przez dodanie 2 µM ADP i zbadana w agregometrze optycznym. Panel B: Analiza krzywej ROC hamowania agregacji płytek krwi, w której czułość jest wykreślona względem specyficzności dla różnych punktów odcięcia. Każdy punkt na krzywej ROC reprezentuje parę czułość/specyficzność odpowiadającą konkretnemu progowi decyzyjnemu, jak opisano w Metodach i Materiałach.
Zależność między pTi a indukowanym aspiryną hamowaniem agregacji płytek przez ADP w AMI, ACS i w normalnym PRP.
Jak pokazano na (Figura 2, Panel A), wzrost pTi okazał się odwrotnie związany z zakresem indukowanego aspiryną hamowania agregacji płytek. Innymi słowy, wzrost pTi, który był maksymalny w przypadku AMI, prowadził również do rozwoju maksymalnej oporności płytek na hamujący wpływ aspiryny (Współczynnik korelacji, Pearson’s r= -0,967, z p<0.001), a indukowane aspiryną hamowanie agregacji płytek było maksymalnie związane z całkowitym brakiem pTi w osoczu prawidłowym, natomiast poziom pTi w ACS był większy niż w osoczu prawidłowym, co świadczyło o obecności troponiny I w osoczu ACS, aczkolwiek mniejszej niż w AMI. Analiza krzywej operatora odbiornika (ROC) wykazała 85% czułość (95% przedział ufności (CI): 81,0-92,0) i 78% swoistość (95% CI: 75,0-80,0, P<0,0001). Obszar pod krzywą (AUC) badany za pomocą analizy ROC wynosił 0,739 (Rysunek 2, Panel B).
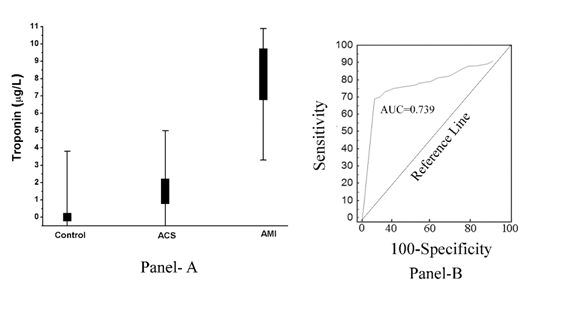
Rysunek 2. Poziom troponiny I w osoczu u osób z normalnym, ACS i AMI oraz jego analiza ROC. Panel A: Poziom pTi został oznaczony metodą ELISA przy użyciu przeciwciała Troponina I, jak opisano w Materiałach i Metodach. Każdy punkt jest w rzeczywistości nakładaniem się 50 normalnych, 30 ACS i 50 pacjentów z AMI. Panel B: Analiza krzywej ROC poziomów pTi u pacjentów w normie (bez choroby), AMI (z chorobą) została skonstruowana przy użyciu MedCalc, jak opisano w Metodach i Materiałach.
Dyskusja
Ostry zawał mięśnia sercowego, zgłaszany jako spowodowany przez zakrzepicę, która powoduje śmierć komórek serca, może być prawdopodobnie najbardziej niebezpiecznym zaburzeniem zakrzepowym, które prowadzi do dużej liczby zgonów wśród ofiar. W przeciwieństwie do ACS, gdzie nawrotom choroby ma zapobiegać aspiryna poprzez hamowanie nadmiernej agregacji płytek krwi, w AMI płytki krwi są oporne na hamujące działanie tego związku ze względu na pojawienie się w krążeniu izoformy 2 dermcydyny (DCN-2). Niestety, ze względu na brak indukowanego aspiryną hamowania agregacji płytek, większość ofiar pierwszego zawału miała nawrót AMI w ciągu kilku miesięcy i ulegała temu schorzeniu. Ponieważ DCN-2 został zgłoszony jako silny inhibitor syntezy tlenku azotu (NO) indukowanej aspiryną. Niedawno doniesiono, że poprzez usunięcie związanego DCN-2 z powierzchni płytek krwi poprzez zwiększoną syntezę NO w płytkach krwi, możliwe jest ponowne uwrażliwienie płytek krwi z AMI na działanie aspiryny.
Nie tylko leczenie i zapobieganie AMI poprzez odpowiednią interwencję terapeutyczną pozostaje problematyczne, nawet diagnostyka laboratoryjna tego stanu, zróżnicowana z występowaniem ACS, pozostaje zaporowo droga dla wielu laboratoriów na świecie, co jest zwykle potrzebne do potwierdzenia AMI przez poziom pTi. Wynika to z faktu, że zarówno troponina I, jak i jej przeciwciało są nie tylko drogie, ale samo badanie metodą ELISA wymaga specjalnego sprzętu oraz niezbędnych substancji chemicznych i materiałów, co może być procedurą czasochłonną i w sytuacji, gdy szybkie i potwierdzone wystąpienie AMI jest niezbędne do interwencji terapeutycznej. Ponadto, interakcja pomiędzy antygenem i jego przeciwciałem nie przebiega zgodnie z dobrze znaną stechiometrią chemiczną, i jako taka, samo badanie może stwarzać problemy w wiarygodności interpretacji danych. Ponadto, diagnostyka ACS, w odróżnieniu od AMI, poprzez oznaczanie CK-MB w osoczu jest kosztowną procedurą.
Przedstawione powyżej wyniki silnie sugerują możliwość diagnostyki AMI, w odróżnieniu od wystąpienia ACS, poprzez prostą agregometrię płytek krwi przy użyciu zwykłego agregometru laboratoryjnego w ciągu godziny (Czułość= 92% i Swoistość= 100% jak określono w analizie ROC). Krzywa testu diagnostycznego, jak opisano w materiałach i metodach, przechodzi blisko lewego górnego rogu (Figura 1, panel B) implikując blisko 100% dokładność testu diagnostycznego w porównaniu do pTi (Figura 2, panel B).
Ponieważ agregacja płytek krwi w PRP nie może być hamowana przez aspirynę w AMI, ale płytki z PRP od osób z ACS mogą być, diagnoza AMI za pomocą agregometrii płytek krwi może być wydarzeniem ekonomicznym, jak również „wszystko albo nic”, tj.Tzn. agregacja płytek krwi z AMI mogła być lub nie mogła być w ogóle osiągnięta przez leczenie PRP aspiryną, podczas gdy agregacja płytek krwi od pacjentów z ACS mogła być wyraźnie hamowana przez ten sam związek (Rycina 1). Stwierdzono jednak, że nawet płytki z ACS były nieco bardziej oporne na hamujące działanie aspiryny niż płytki prawidłowe. Z drugiej strony, płytki z AMI były maksymalnie oporne na działanie aspiryny, co było odwrotnie proporcjonalne do poziomu pTi (współczynnik korelacji (r) pomiędzy poziomem pTi a % inhibicji przez aspirynę wynosił -0.967, p<0.001).
W powyższym kontekście należy wspomnieć, że szybkie i potwierdzające rozpoznanie AMI jest niezbędne do zastosowania terapii trombolitycznej, która może zmniejszyć śmiertelność w AMI o 30-50% . Należy również zwrócić uwagę, że około 50% pacjentów z podwyższonym pTi nie ma ani uniesienia odcinka ST, ani załamka Q w EKG, w związku z czym diagnostyka agregometryczna płytek krwi w AMI może być metodą jeszcze bardziej przydatną diagnostycznie niż EKG, a jednocześnie jest znacznie tańsza od metody ELISA do oznaczania pTi.
Oznaczenie ilościowe pTi w krążeniu pacjentów z AMI jest zwykle wykonywane jako białko markerowe potwierdzające AMI. We wstępnych badaniach stwierdzono jednak, że pTi jest również inhibitorem syntezy NO i silnym induktorem agregacji płytek krwi w zakresie (nM) zbliżonym do poziomu pTi w osoczu chorych z AMI (dane niepublikowane). Ponieważ jednak poziom troponiny I w ACS był większy niż w normalnym osoczu, ale znacznie mniejszy niż w przypadku AMI, wyniki te sugerowały, że wzrost pTi występował również w ACS, ale prawie 6 razy mniejszy niż w AMI. Wyniki te sugerowały jednak, że zwiększone pTi w porównaniu z normalnym osoczem samo w sobie może niekoniecznie potwierdzać występowanie AMI w odróżnieniu od możliwego występowania ACS.
Ostatnio donosiliśmy, że charakterystyczny ból dławicowy w AMI był związany ze znacznym obniżeniem poziomu NO w osoczu, które wynikało z hamowania syntezy NO przez DCN-2 lub inne ogólnoustrojowe inhibitory syntazy tlenku azotu. Ponieważ stwierdzono, że pTi jest nowym czynnikiem agregującym płytki krwi (niepublikowane), poprzez hamowanie NOS w płytkach krwi, możliwe jest, że sam pTi może być zaangażowany w ból dławicowy, przynajmniej częściowo, w AMI. Rozlanie się pTi w krążeniu z mięśnia sercowego może być samo w sobie trombogenne i może przyczyniać się do rozwoju oporności na hamujące działanie aspiryny w płytkach krwi w AMI, podobnie jak w przypadku DCN- 2, co prowadzi do zapoczątkowania lub nasilenia dolegliwości. A zatem obecność pTi sama w sobie może mieć złowieszczą rolę w rozwoju oporności na hamujące działanie aspiryny w płytkach krwi w AMI, prowadząc do nawrotu choroby.
- Colman RW, Walsh PN (1987) Haemostasis andthrombosis. In: Colman RW, Hirsh J, Maeder VJ, Salzman EW, eds. Philadelphia, PA (USA), J.B. Lippincott: 594-605.
- Fuster V, Badimon J, Chesebro JH, Fallon JT (1996) Plaque rupture, thrombosis, and therapeutic implications. Haemostasis 4: 269-284.
- Page DL, Caulfield JB, Kastor JA, DeSanctis RW, Sanders CA (1971) Myocardial changes associated with cardiogenic shock. N Engl J Med 285: 133-137.
- Chakraborty K, Khan GA, Banerjee P, Ray U, Sinha AK (2003) Inhibition of human blood platelet aggregation and the stimulation of nitric oxide synthesis by aspirin. Platelets 14: 421-427.
- Zweig MH1, Campbell G (1993) Receiver-operating characteristic (ROC) plots: a fundamental evaluation tool in clinical medicine. Clin Chem 39: 561-577.
- Bank S, Jana P, Maiti S, Guha S, Sinha AK (2014) Dermcidin isoform-2 induced nullification of the effect of acetyl salicylic acid in platelet aggregation in acute myocardial infarction. Sci Rep 4: 5804.
- Ghosh R, Karmohapatra SK, Bhattacharya M, Bhattacharya R, Bhattacharya G (2011) The appearance of dermcidin isoform 2, a novel platelet aggregating agent in the circulation in acute myocardial infarction that inhibits insulin synthesis and the restoration by acetyl salicylic acid of its effects. J Thromb Thrombolysis 31: 13-21.
- Moreno FL, Villanueva T, Karagounis LA, Anderson JL (1994) Reduction in QT interval dispersion by successful thrombolytic therapy in acute myocardial infarction. TEAM-2 Study Investigators. Circulation 90: 94-100.
- Ghosh R, Ray U, Jana P, Bhattacharya R, Banerjee D, et al. (2014) Reduction of death rate due to acute myocardial infarction in subjects with cancers through systemic restoration of impaired nitric oxide. PLoS One 9: e88639.
.