|
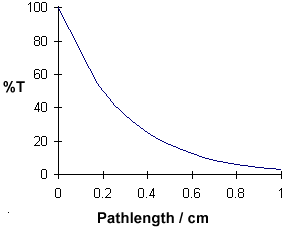
Długość ścieżki / cm
|
0
|
0.4
|
1.0
|
||
|
%T
|
50
|
25
|
12.5
|
6,25
|
3.125
|
|
Wchłanianie
|
0
|
0,6
|
0,9
|
 |
 |
A = ebc mówi nam, że absorbancja zależy od całkowitej ilości związku absorbującego w drodze światła przez kuwetę. Jeśli wykreślimy absorbancję względem stężenia, otrzymamy linię prostą przechodzącą przez początek (0,0).
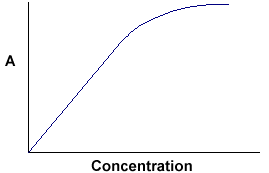 |
Zauważ, że prawo nie jest przestrzegane przy wysokich stężeniach. To odchylenie od prawa nie jest tutaj rozpatrywane. |
Liniowa zależność pomiędzy stężeniem a absorbancją jest zarówno prosta jak i nieskomplikowana, dlatego wolimy wyrażać prawo Beera-Lamberta używając absorbancji jako miary absorpcji, a nie %T.
Pytanie : Jakie znaczenie ma molowa absorbancja, e ?
Odpowiedź : Na początek przekształcimy równanie A = ebc :
e = A / bc
Słowem, zależność tę można określić jako „e jest miarą ilości światła pochłoniętego na jednostkę stężenia”.
Chłonność molowa jest stałą dla danej substancji, więc jeśli stężenie roztworu zmniejszy się o połowę, to absorbancja również się zmniejszy, co jest dokładnie tym, czego można by się spodziewać.
Przyjrzyjmijmy związek o bardzo wysokiej wartości absorbancji molowej, powiedzmy 100 000 L mol-1 cm-1, który znajduje się w roztworze w kuwecie o długości drogi 1 cm i daje absorbancję 1.
e = 1 / 1 ´ c
Więc, c = 1 / 100,000 = 1 ´ 10-5 mol L-1
Teraz weźmy związek o bardzo niskiej wartości e, powiedzmy 20 L mol-1 cm-1, który jest w roztworze w kuwecie o długości ścieżki 1 cm i daje absorbancję 1.
e = 1 / 1 ´ c
Więc, c = 1 / 20 = 0.05 mol L-1
Odpowiedź jest teraz oczywista – związek o wysokiej absorpcji molowej bardzo efektywnie pochłania światło (o odpowiedniej długości fali), a więc niskie stężenia związku o wysokiej absorpcji molowej mogą być łatwo wykryte.
Pytanie: Jaka jest absorpcja molowa jonów Cu2+ w wodnym roztworze CuSO4 ? Jest to albo 20, albo 100 000 L mol-1 cm-1
Odpowiedź : Domyślam się, że myślisz, że wyższa wartość jest poprawna, ponieważ roztwory siarczanu miedzi, które widziałeś, mają zwykle piękny jasnoniebieski kolor. Jednak rzeczywista wartość absorbancji molowej wynosi 20 L mol-1 cm-1 ! Jasnoniebieski kolor jest widoczny, ponieważ stężenie roztworu jest bardzo wysokie.
B-karoten jest związkiem organicznym występującym w warzywach i jest odpowiedzialny za kolor marchwi. Występuje on w bardzo niskich stężeniach. Nie zdziw się, jeśli dowiesz się, że molowa absorpcyjność b-karotenu wynosi 100 000 L mol-1 cm-1 !
Review your learning
Powinieneś teraz dobrze rozumieć prawo Beera-Lamberta; różne sposoby, w jakie możemy opisać absorpcję i jak one się ze sobą wiążą. Powinieneś także rozumieć znaczenie molowej absorbancji i jak wpływa ona na granicę wykrywalności danego związku.
![]()
Powinieneś także rozumieć, jak ważna jest molowa absorbancja i jak wpływa ona na granicę wykrywalności danego związku.