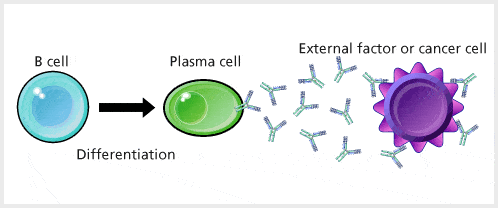
L’anticorpo (Ab) noto anche come immunoglobulina (Ig) è la grande proteina a forma di Y prodotta dal sistema immunitario del corpo quando rileva sostanze nocive, chiamate antigeni come batteri e virus. La produzione di anticorpi è una funzione importante del sistema immunitario ed è svolta da un tipo di globulo bianco chiamato cellula B (linfocita B), cellule B differenziate chiamate plasmacellule. Gli anticorpi prodotti si legano a specifici antigeni espressi in fattori esterni e cellule tumorali.
Struttura dell’anticorpo
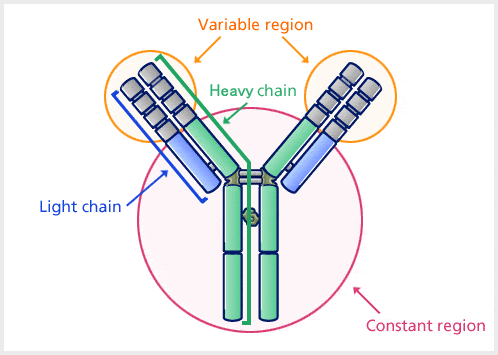
Gli anticorpi sono proteine plasmatiche globulari pesanti (~150 kDa). La struttura di base di tutti gli anticorpi è la stessa.
Fonte: Kyowa Hakko Kirin Co., Ltd
Ci sono quattro catene polipeptidiche: due catene pesanti identiche e due catene leggere identiche collegate da legami disolfuro. La catena leggera (L) consiste in polipeptidi di circa 22.000 Da e la catena pesante (H) consiste in polipeptidi più grandi di circa 50.000 Da o più. Ci sono cinque tipi di catena pesante Ig (nei mammiferi) denotati dalle lettere greche: α, δ, ε, γ, e μ. Ci sono due tipi di catena leggera Ig (nei mammiferi), che sono chiamati lambda (λ) e kappa (κ).
Un anticorpo è composto da una regione variabile e una regione costante, e la regione che cambia in varie strutture a seconda delle differenze negli antigeni è chiamata regione variabile, e la regione che ha una struttura costante è chiamata regione costante.
Fonte: Sino Biological Inc.
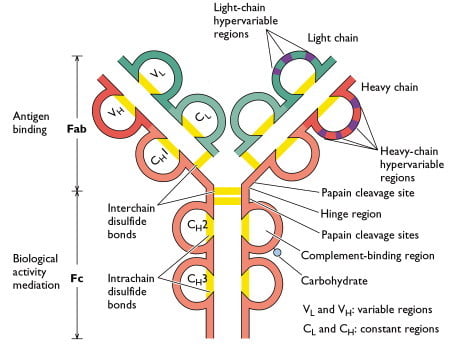
Ogni catena pesante e leggera in una molecola di immunoglobulina contiene una regione variabile amino-terminale (V) che consiste di 100 a 110 aminoacidi e differisce da un anticorpo all’altro. Il resto di ogni catena nella molecola – la regione costante (C) presenta una variazione limitata che definisce i due sottotipi di catena leggera e le cinque sottoclassi di catene pesanti. Alcune catene pesanti (α, δ, γ) contengono anche una regione cerniera ricca di proline. Le porzioni amino terminali, corrispondenti alle regioni V, si legano all’antigene; le funzioni effettrici sono mediate dai domini carbossi-terminali. Le catene pesanti ε e μ, che mancano di una regione di cerniera, contengono un ulteriore dominio al centro della molecola. CHO denota un gruppo di carboidrati legato alla catena pesante.
Classi/Tipi di anticorpi
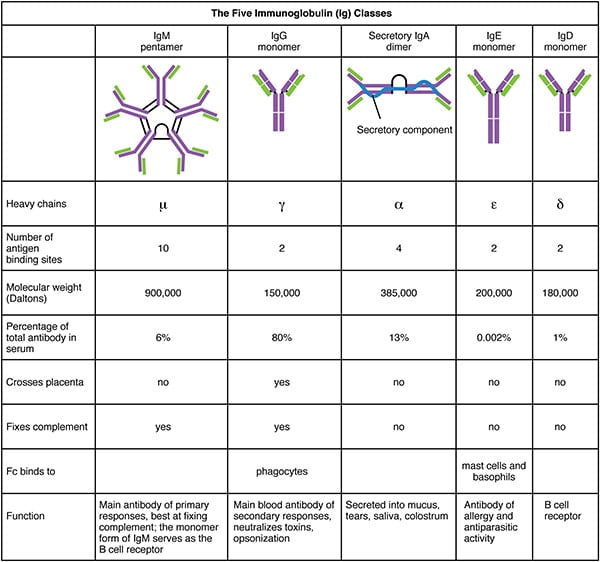
Il siero che contiene anticorpi specifici all’antigene è chiamato antisiero. I 5 tipi – IgG, IgM, IgA, IgD, IgE – (isotipi) sono classificati secondo il tipo di regione costante della catena pesante, e sono distribuiti e funzionano diversamente nell’organismo.
Funzioni degli anticorpi
- Le IgG forniscono una protezione a lungo termine perché persistono per mesi e anni dopo la presenza dell’antigene che ne ha scatenato la produzione.
- Le IgG proteggono contro i batteri, i virus, neutralizzano le tossine batteriche, innescano sistemi di proteine complementari e legano gli antigeni per migliorare l’efficacia della fagocitosi.
- La funzione principale delle IgA è di legare gli antigeni sui microbi prima che invadano i tessuti. Aggrega gli antigeni e li mantiene nelle secrezioni in modo che quando la secrezione viene espulsa, lo stesso vale per l’antigene.
- Le IgA sono anche la prima difesa per le superfici delle mucose come l’intestino, il naso e i polmoni.
- Le IgM sono coinvolte negli antigeni del gruppo sanguigno ABO sulla superficie dei RBC.
- IgM migliorano l’ingestione di cellule per fagocitosi.
- IgE si legano ai mastociti e ai basofili che partecipano alla risposta immunitaria.
- Alcuni scienziati pensano che lo scopo delle IgE sia di fermare i parassiti.
- IgD è presente sulla superficie delle cellule B e gioca un ruolo nell’induzione della produzione di anticorpi.