Conocimientos clave & Resumen:
- La entalpía de red es una medida de la fuerza entre los iones de un sólido iónico.
- La energía de red es la energía necesaria para separar 1 mol de un sólido iónico en iones gaseosos
- La entalpía de red aumenta con las cargas y disminuye con el tamaño de los iones.
- El ciclo de Born-Haber representa una serie de pasos que conducen a la formación de un compuesto iónico a partir de sus iones gaseosos constituyentes
En primer lugar, ¿qué es la red?
En química, cuando se utiliza el término red, solemos referirnos a una red cristalina que es una sustancia muy transparente con una forma geométrica regular. La disposición tridimensional de los átomos o iones en un patrón cristalino organizado se denomina red cristalina. Por ejemplo, si decimos «red cristalina de cloruro de sodio», nos referimos a un patrón geométrico regular de iones de sodio y cloruro.
La entalpía de red se aplica normalmente a los compuestos iónicos, que son compuestos formados por metales y no metales. Los valores de entalpía de red (H) suelen representarse en kilojulios (KJ). La entalpía de red y la energía de red se utilizan comúnmente como si significaran exactamente lo mismo, aunque existe una diferencia entre ellas que está relacionada con las condiciones en las que se calculan.
La energía de red es la energía necesaria para separar 1 mol de un sólido iónico en iones gaseosos.
Si tomamos como ejemplo el NaCl y queremos preparar una red de cristales de cloruro de sodio, la entalpía de red del cloruro de sodio será la energía necesaria para formar un cristal sólido de cloruro de sodio a partir de iones gaseosos de sodio y cloruro.
La formación de un cristal sólido suele liberar una enorme cantidad de energía al entorno; de ahí que el proceso sea exotérmico y, por tanto, su valor sea siempre negativo.
Na (s) +1 Cl2 → NaCl (s) ΔH = – 411KJ
La entalpía de red es una medida de la fuerza entre los iones de un sólido iónico. Cuanto mayor es la entalpía de red, más fuertes son las fuerzas y mayor es la energía liberada en el entorno cuando se forma el cristal. Esta energía se libera cuando se forman los enlaces y es necesaria para romperlos. Esta fuerza deja de existir sólo cuando la sal se encuentra en estado gaseoso, por lo tanto cuando los iones están dispersos muy lejos unos de otros.
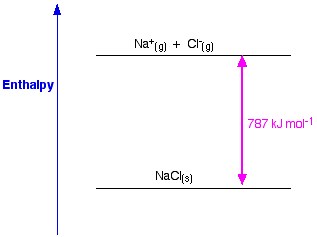
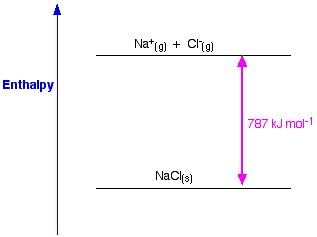
Figura 1. Entalpía de red del NaCl. Www.chemguide.co.uk.
Los principales factores que afectan a la entalpía de red son la carga y el radio de los iones. Analicémoslos uno a uno.
Cargas de los iones
Cuanto mayor sea la carga de los iones, mayor será la atracción entre ellos y, en consecuencia, mayor será la entalpía de red. Por ejemplo, el cloruro de sodio NaCl y el óxido de magnesio MgO tienen exactamente la misma disposición de los iones, pero las entalpías de red son muy diferentes. Como el Mg tiene 2 cargas positivas +2, atraen más las cargas negativas O -2 que la carga del Na + 1 que atrae sólo una negativa Cl – 1 .
Radio de los iones
Cuanto más pequeños son los radios de los iones, más cerca están las cargas, mayor es la atracción entre ellos y en consecuencia mayor es la entalpía de red. Por lo tanto, a medida que aumenta el tamaño iónico, disminuye la energía de red. Utilizando el ejemplo anterior, la entalpía del MgO es también mucho mayor que la del NaCl porque el átomo de Mg es más pequeño que el Na y el átomo de O es más pequeño que el Cl.
La energía de red, por tanto, disminuye hacia abajo en un grupo de la tabla periódica.
Abajo hay una imagen muy útil de la tabla periódica y las tendencias de todas las principales fuerzas importantes y características de los átomos. Observe que la energía de red aumenta en el período y disminuye en el grupo en la tabla periódica.
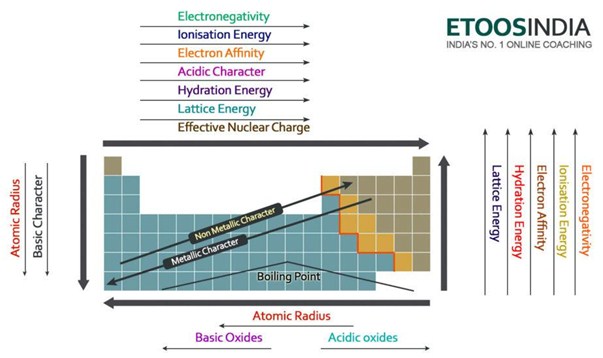
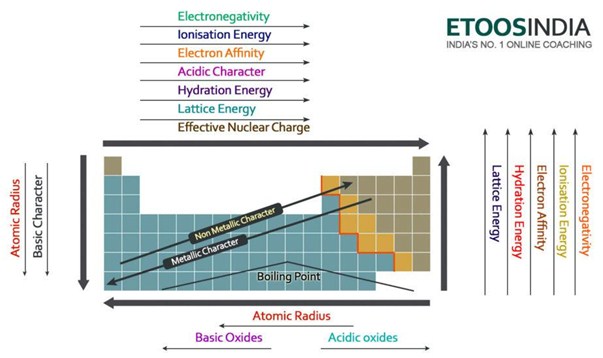
Figura2. Tendencias de las principales fuerzas y propiedades de los átomos en la tabla periódica. http://blog.etoosindia.com/periodic-table-trends/
Cómo calcular las energías entálpicas.
Para calcular la energía entálpica es necesario estar familiarizado con la Ley de Hess:
El cambio de entalpía que acompaña a un cambio químico es independiente de la ruta por la que se produce el cambio químico.
También necesitamos definir la entalpía de atomización, ΔH°a:
La entalpía de atomización estándar es el cambio de entalpía cuando se forma 1 mol de átomos gaseosos a partir del elemento en su estado estándar.
El cambio de entalpía de atomización es siempre positivo.
Para calcular las entalpías necesitamos seguir El ciclo de Born-Haber. Representa una serie de pasos que conducen a la formación de un compuesto iónico a partir de sus iones gaseosos constituyentes.El ciclo de Born-Haber se ocupa de los compuestos iónicos sólo donde los metales tienden a formar cationes, y los no metales forman aniones.
Sigamos utilizando el NaCl como ejemplo para explicar cómo funciona el ciclo de Born-Haber.
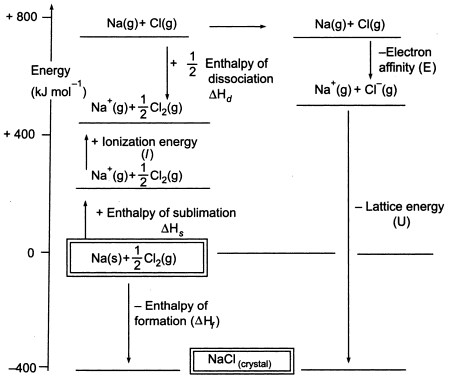
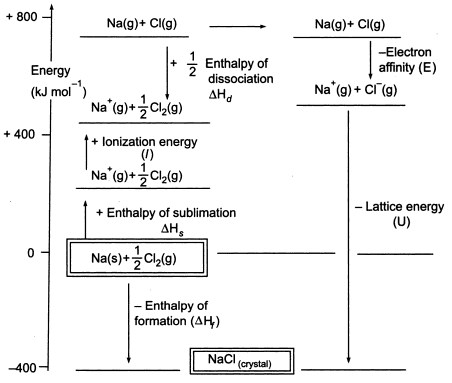
Fig3. Ciclo Born-Haber del NaCl
Como tenemos que producir átomos gaseosos para poder utilizar la siguiente etapa del ciclo, el primer paso del ciclo implica la formación de sodio metal gaseoso a partir de sodio metal sólido. En este paso endotérmico, la energía de sublimación del sodio es de +108 KJ.
El segundo paso, también es endotérmico, y es la formación de un átomo de cloro a partir de una molécula de cloro diatómica, ya que tenemos que producir átomos gaseosos para poder utilizar la siguiente etapa del ciclo. La energía de disociación del enlace de la molécula de cloro diatómica es de +122 KJ.
El tercer paso es la ionización del átomo de sodio gaseoso para formar un ion sodio. Como es de esperar, el cambio de energía en el proceso se denomina energía de ionización del sodio.Este paso es endotérmico, siendo la energía de ionización del sodio de +496 KJ. Las energías de ionización pasan de átomos gaseosos a iones gaseosos de carga única positiva.
El cuarto paso es la adición de un electrón a un átomo de cloro gaseoso, que se define como la afinidad electrónica del cloro. Este paso es exotérmico, -349 KJ. Así, del tercer y cuarto paso obtenemos los iones sodio y cloruro. Las afinidades electrónicas pasan de átomos gaseosos a iones gaseosos con carga única negativa.
Ahora, el paso final es formar el cristal de cloruro de sodio a partir de iones de sodio y cloruro. Los iones gaseosos positivos y negativos que podemos convertir en el cloruro de sodio sólido utilizando la entalpía de formación de la red. Esta es la energía de red (U), cuyo valor se le proporcionará para calcular la entalpía de red o H. Aquí, U de NaCl es -788 KJ.
Calculemos ahora la entalpía de red.
Hf = Hsublimación(Na) + Energía de ionización (Na) + Hdisociación(Cl2) + Afinidad de electrones(Cl) + U (entalpía de red)