Key Facts & Samenvatting:
- Roosterenthalpie is een maat voor de sterkte van de krachten tussen de ionen in een ionische vaste stof.
- Rooster-energie is de energie die nodig is om 1 mol van een ionische vaste stof te scheiden in gasvormige ionen
- Roosterenthalpie neemt toe met de ladingen en neemt af met de grootte van de ionen.
- De Born-Haber-cyclus vertegenwoordigt een reeks stappen die leidt tot de vorming van een ionische verbinding uit de samenstellende gasvormige ionen
Vooreerst, wat is een rooster?
In de chemie verwijzen we met de term rooster meestal naar een kristalrooster, een zeer transparante stof met een regelmatige geometrische vorm. De 3-dimensionale ordening van atomen of ionen in een georganiseerd kristallijn patroon wordt kristalrooster genoemd. Als we bijvoorbeeld zeggen “natriumchloride kristalrooster”, bedoelen we een regelmatig geometrisch patroon van natrium- en chloride-ionen.
Roosterenthalpie is gewoonlijk van toepassing op ionische verbindingen, dat zijn verbindingen gevormd door metalen en niet-metalen. Roosterenthalpie (H)-waarden worden meestal weergegeven in kilojoule (KJ). Roosterenthalpie en roosterenergie worden vaak gebruikt alsof ze precies hetzelfde betekenen, hoewel er een verschil tussen beide is dat verband houdt met de omstandigheden waaronder ze worden berekend.
Roosterenthalpie is de energie die nodig is om 1 mol van een ionische vaste stof te scheiden in gasvormige ionen.
Als we NaCl als voorbeeld nemen en we willen een natriumchloridekristalrooster bereiden, dan is de roosterenthalpie van natriumchloride de energie die nodig is om uit gasvormige natrium- en chloride-ionen een vast natriumchloridekristal te vormen.
Bij de vorming van een vast kristal komt gewoonlijk een enorme hoeveelheid energie in de omgeving vrij; het proces is dus exotherm, en de waarde ervan is dus altijd negatief.
Na (s) +1 Cl2 → NaCl (s) ΔH = – 411KJ
Roosterenthalpie is een maat voor de sterkte van de krachten tussen de ionen in een ionische vaste stof. Hoe groter de roosterenthalpie, hoe sterker de krachten, en hoe hoger de energie die in de omgeving vrijkomt bij de vorming van het kristal. Deze energie komt vrij wanneer bindingen worden gemaakt en is nodig om bindingen te verbreken. Deze kracht houdt pas op te bestaan wanneer het zout zich in de gasvormige toestand bevindt, dus wanneer de ionen te ver van elkaar verwijderd zijn.
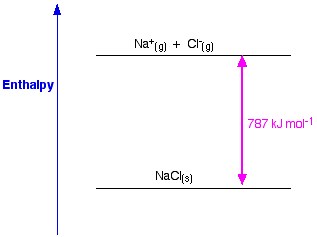
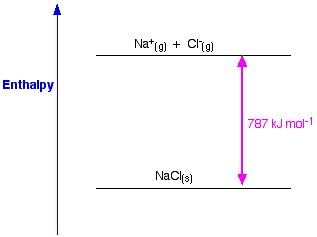
Figuur 1. Roosterenthalpie van NaCl. Www.chemguide.co.uk.
De belangrijkste factoren die van invloed zijn op de roosterenthalpie zijn de ionenlading en de ionenradii. Laten we ze een voor een analyseren.
IonenKRARGES
Hoe groter de ladingen van de ionen zijn, des te groter is de aantrekkingskracht tussen de ionen, en dus des te groter is de roosterenthalpie. Natriumchloride NaCl en magnesiumoxide MgO hebben bijvoorbeeld precies dezelfde ordening van ionen, maar de rooster-enthalpie is heel verschillend. Aangezien Mg 2 positieve ladingen +2 heeft, trekken zij de negatieve ladingen O -2 meer aan dan de lading van Na + 1 die slechts één negatieve Cl – 1 aantrekt.
Ionenstralen
Hoe kleiner de straal van de ionen is, hoe dichter de ladingen bij elkaar liggen, hoe groter de aantrekkingskracht tussen de ionen is en hoe groter bijgevolg de roosterenthalpie is. Daarom, als de ionengrootte toeneemt, neemt de roosterenergie af. In het voorbeeld hierboven is de enthalpie van MgO ook veel groter dan die van NaCl, omdat het Mg-atoom kleiner is dan Na en het O-atoom kleiner dan Cl.
De rooster-energie neemt dus af naar beneden een groep op het periodiek systeem.
Hieronder staat een zeer bruikbaar plaatje van het periodiek systeem en de trends van alle belangrijke krachten en kenmerken van de atomen. Merk op dat de tralie-energie toeneemt in de periode en afneemt in de groep op het periodiek systeem.
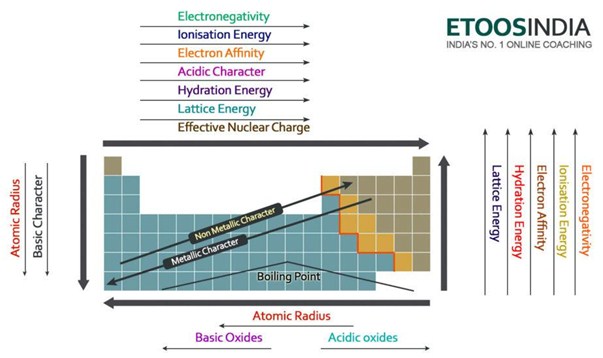
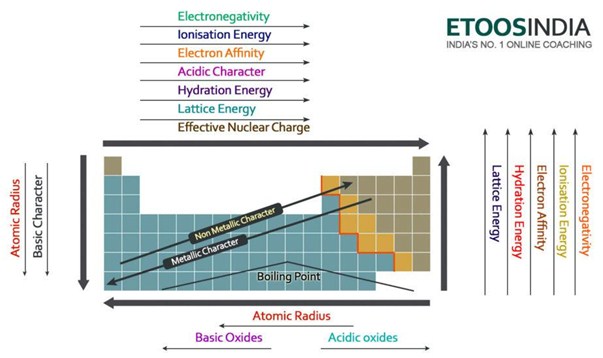
Figuur2. Tendensen van de belangrijkste krachten en atoomeigenschappen in het periodiek systeem. http://blog.etoosindia.com/periodic-table-trends/
Hoe enthalpie-energieën te berekenen.
Om de enthalpie-energie te berekenen is het nodig bekend te zijn met de wet van Hess:
De enthalpieverandering bij een chemische verandering is onafhankelijk van de route waarlangs de chemische verandering plaatsvindt.
We moeten ook de atomisatie-enthalpie, ΔH°a, definiëren:
De standaard atomisatie-enthalpie is de enthalpieverandering wanneer 1 mol gasatomen wordt gevormd uit het element in zijn standaardtoestand.
De atomisatie-enthalpieverandering is altijd positief.
Om de enthalpie te berekenen, moeten we de Born-Haber-cyclus volgen. Deze cyclus geeft een reeks stappen weer die leiden tot de vorming van een ionische verbinding uit de samenstellende gasvormige ionen.De Born-Haber-cyclus behandelt alleen ionische verbindingen waarbij metalen de neiging hebben kationen te vormen, en niet-metalen anionen.
Laten we NaCl als voorbeeld blijven gebruiken om uit te leggen hoe de Born-Haber-cyclus werkt.
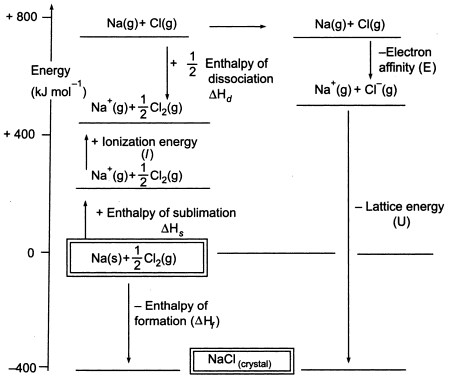
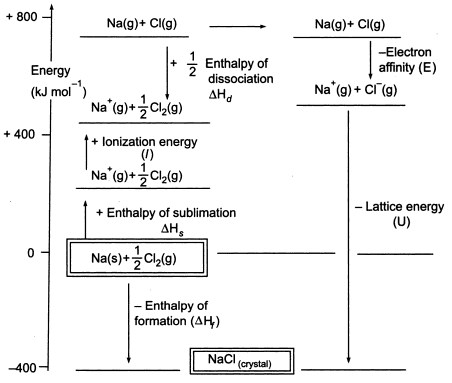
Figuur3. Born-Haber-cyclus van NaCl
Aangezien we gasvormige atomen moeten produceren om de volgende stap in de cyclus te kunnen gebruiken, bestaat de eerste stap in de cyclus uit de vorming van gasvormig natriummetaal uit vast natriummetaal. In deze endotherme stap is de sublimatie-energie van natrium +108 KJ.
De tweede stap, is ook endotherm, en het is de vorming van een chlooratoom uit een diatomisch chloormolecuul omdat we gasvormige atomen moeten produceren zodat we de volgende stap in de cyclus kunnen gebruiken. De bindingsdissociatie-energie van het diatomaire chloormolecuul is +122 KJ.
De derde stap is de ionisatie van het gasvormige natriumatoom tot een natriumion. Zoals te verwachten, wordt de energieverandering in dit proces aangeduid als de ionisatie-energie van natrium. Deze stap is endotherm, waarbij de ionisatie-energie van natrium +496 KJ bedraagt. De ionisatie-energie gaat van gasvormige atomen naar gasvormige enkelvoudig geladen positieve ionen.
De vierde stap is de toevoeging van een elektron aan een gasvormig chlooratoom, wat wordt gedefinieerd als de elektronenaffiniteit van chloor. Deze stap is exotherm, -349 KJ. Dus, uit de derde en de vierde stap krijgen we natrium- en chloride-ionen. De elektronen affiniteiten gaan van gasvormige atomen naar gasvormige enkel geladen negatieve ionen.
Nu, de laatste stap is het vormen van natriumchloride kristal uit natrium en chloride ionen. De positieve en negatieve gasvormige ionen die we kunnen omzetten in het vaste natriumchloride gebruiken we met de enthalpie van de roostervorming. Dit is de roosterenergie (U), waarvan je de waarde krijgt voor de berekening van de roosterenthalpie of H. Hier is U van NaCl -788 KJ.
Laten we nu de roosterenthalpie berekenen.
Hf = Hsublimatie(Na) + Ionisatie-energie (Na) + Hdissociatie(Cl2) + Elektronenaffiniteit(Cl) + U (roosterenthalpie)