Key Facts & Summary:
- 格子エンタルピーは、イオン性固体中のイオン間の力の強さの尺度である。
- 格子エネルギーは、1molのイオン性固体を気体のイオンに分離するのに必要なエネルギーである
- 格子エンタルピーは、イオンの電荷に応じて増加し、イオンの大きさに応じて減少する
- ボルン-ハーバーサイクルは、構成する気体のイオンからイオン性化合物の形成に至る一連のステップを表している
まず、格子とは何でしょうか?
化学の世界で「格子」という言葉を使う場合、通常は、規則的な幾何学的形状を持つ透明度の高い物質である結晶格子を指します。 原子やイオンが組織的に結晶化して3次元的に配置されたものを結晶格子といいます。
格子エンタルピーは通常、金属と非金属で形成される化合物であるイオン性化合物に適用されます。 格子エンタルピー(H)の値は通常、キロジュール(KJ)で表されます。
格子エネルギーとは、1molのイオン性固体をガス状のイオンに分離するのに必要なエネルギーです。
塩化ナトリウムを例にとると、塩化ナトリウムの格子エンタルピーは、気体のナトリウムイオンと塩化物イオンから固体の塩化ナトリウム結晶を形成するのに必要なエネルギーとなります。
固体結晶の形成は、通常、大量のエネルギーを環境中に放出するため、そのプロセスは発熱性であり、したがってその値は常に負である。
Na (s) +1 Cl2 → NaCl (s) ΔH = – 411KJ
格子エンタルピーは、イオン性固体中のイオン間の力の強さを示す指標である。 格子エンタルピーが大きいほど力が強く、結晶が形成される際に環境中に放出されるエネルギーが大きいことを意味する。 このエネルギーは、結合を作るときに放出され、結合を切断するときに必要となる。
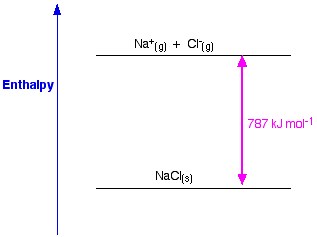
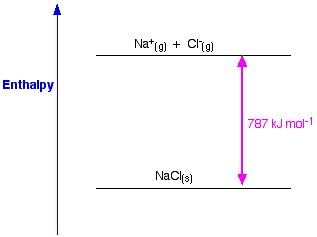
図1. NaClの格子エンタルピー。 Www.chemguide.co.uk.
格子エンタルピーに影響を与える主な要因は、イオンの電荷とイオンの半径です。
イオンの電荷
イオンの電荷が大きいほど、イオン間の引力が大きくなり、その結果、格子エンタルピーが大きくなります。 例えば、塩化ナトリウムNaClと酸化マグネシウムMgOは、イオンの配列は全く同じですが、格子エンタルピーは大きく異なります。
イオンの半径
イオンの半径が小さければ小さいほど、電荷が近くなり、それらの間の引力が大きくなり、その結果、格子エンタルピーが大きくなります。 したがって、イオンの大きさが大きくなると、格子エネルギーは小さくなります。
格子エネルギーは、周期表のグループごとに減少していきます。
下の図は、周期表の非常に便利な図で、すべての主要な力と原子の特性の傾向を示しています。
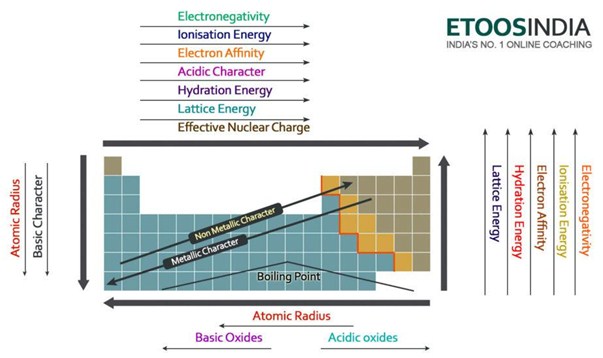
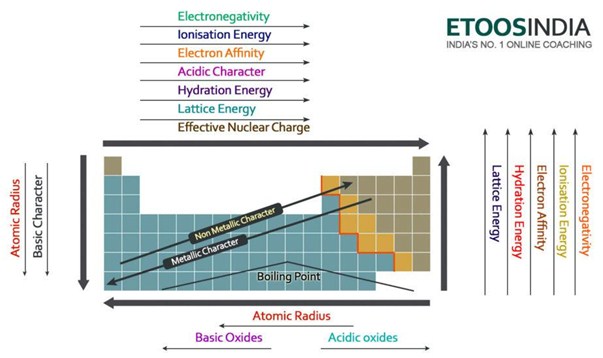
Figure2. 周期表における主な力と原子の性質の傾向。 http://blog.etoosindia.com/periodic-table-trends/
エンタルピーエネルギーの計算方法
エンタルピーエネルギーを計算するためには、ヘスの法則に精通している必要があります:
化学変化に伴うエンタルピー変化は、化学変化が起こる経路とは無関係です。
また、原子化エンタルピーΔH°aを定義する必要があります。
標準的な原子化エンタルピーとは、標準状態の元素から1モルの気体原子が生成されるときのエンタルピー変化のことです。
エンタルピーを計算するためには、ボルン-ハーバーサイクルに従う必要があります。これは、構成する気体イオンからイオン化合物が形成されるまでの一連のステップを表しています。ボルン-ハーバーサイクルでは、金属が陽イオンを形成し、非金属が陰イオンを形成する傾向があるイオン化合物のみを扱います。
ここでは、引き続きNaClを例にとり、ボルン-ハーバーサイクルの仕組みを説明します。
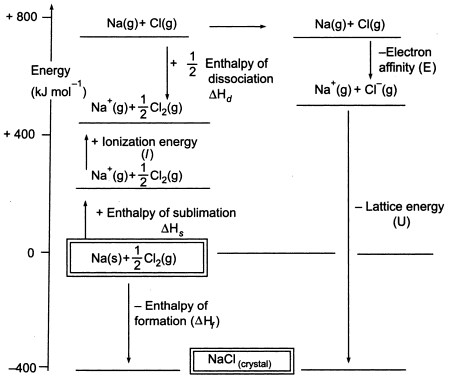
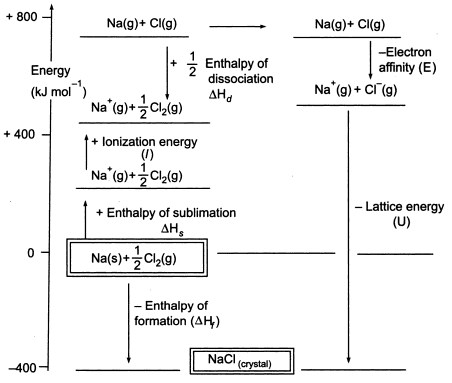
図3. NaClのボルン-ハーバーサイクル
サイクルの次の段階で使用できるように、気体の原子を生成する必要があるため、サイクルの最初の段階では、固体の金属ナトリウムから気体の金属ナトリウムが生成されます。
第2段階では、次のサイクルで使用するために気体原子を生成しなければならないので、二原子塩素分子から塩素原子を生成しますが、このときのナトリウムの昇華エネルギーは+108KJです。 2原子塩素分子の結合解離エネルギーは+122KJです。
第3段階は、ガス状のナトリウム原子がイオン化してナトリウムイオンを形成することです。 このステップは吸熱で、ナトリウムのイオン化エネルギーは+496KJとなります。
第4のステップは、ガス状の塩素原子に電子を付加することで、これを塩素の電子親和力と定義します。 このステップは発熱性で、-349KJです。 つまり、第3ステップと第4ステップからナトリウムイオンと塩化物イオンが得られる。
さて、最後のステップは、ナトリウムと塩化物イオンから塩化ナトリウム結晶を作ることです。 正負の気体イオンは、格子形成エンタルピーを用いて固体の塩化ナトリウムに変換することができます。
ここで、格子形成エンタルピーを計算してみましょう。
Hf = 昇華(Na)+イオン化エネルギー(Na)+解離(Cl2)+電子親和力(Cl)+U(格子形成エンタルピー)