Key Facts & Summary:
- Lattice Enthalpy é uma medida da força das forças entre os iões num sólido iónico.
- Energia da matéria prima é a energia necessária para separar 1 mol de um sólido iónico em iões gasosos
- Entalpia da matéria prima aumenta com as cargas e diminui com o tamanho dos iões.
li> O ciclo Born-Haber representa uma série de passos que conduzem à formação de um composto iónico a partir dos seus iões gasosos constituintes
P>Primeiro de tudo, o que é matéria prima prima prima?
Em química, quando o termo malha é utilizado, referimo-nos normalmente a uma malha de cristal que é uma substância altamente transparente com uma forma geométrica regular. A disposição tridimensional dos átomos ou iões num padrão cristalino organizado no interior é referida como malha de cristal. Por exemplo, se dizemos “malha de cristal de cloreto de sódio”, referimo-nos a um padrão geométrico regular de iões sódio e cloreto.
Entalpia de cristal é normalmente aplicável a compostos iónicos, que são compostos formados por metais e não metálicos. Os valores da entalpia da malha (H) são geralmente representados em kilojoules (KJ). A entalpia e a energia da malha são normalmente utilizadas como se significassem exactamente a mesma coisa, embora haja uma diferença entre elas que se relaciona com as condições em que são calculadas.
Energia da malha é a energia necessária para separar 1 mol de um sólido iónico em iões gasosos.
Se tomarmos NaCl como exemplo e quisermos preparar a malha de cristal de cloreto de sódio, a entalpia da malha de cloreto de sódio será a energia necessária para formar cristal de cloreto de sódio sólido a partir de iões de cloreto e sódio gasoso.
A formação de um cristal sólido liberta geralmente uma enorme quantidade de energia no ambiente; por conseguinte, o processo é exotérmico, e portanto o seu valor é sempre negativo.
Na (s) +1 Cl2 → NaCl (s) ΔH = – 411KJ
Entalpia do cloreto de sódio é uma medida da força das forças entre os iões num sólido iónico. Quanto maior for a entalpia da malha, mais fortes são as forças, e maior é a energia libertada no ambiente quando o cristal é formado. Esta energia é libertada quando as ligações são feitas e é necessária para quebrar as ligações. Esta força só deixa de existir quando o sal está no estado gasoso, portanto quando os iões estão dispersos demasiado longe uns dos outros.
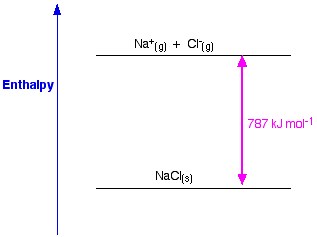
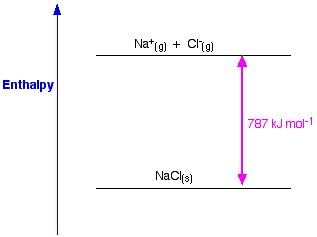
Figure 1. Entalpia da malha de NaCl. Www.chemguide.co.uk.
Os principais factores que afectam a entalpia da malha são a carga de iões e os raios de iões. Vamos analisá-los um a um.
CARGAS DE ÍONES
Quanto maiores forem as cargas dos iões, maiores são as atracções entre eles, e consequentemente maior é a entalpia da rede. Por exemplo, o cloreto de sódio NaCl e o óxido de magnésio MgO têm exactamente a mesma disposição de iões, mas as entalpias da malha são muito diferentes. Como o Mg tem 2 cargas positivas +2, atraem as cargas negativas O -2 mais do que a carga de Na + 1 atraindo apenas um Cl negativo – 1 .
IONS RADII
Quanto menor for o raio dos iões, quanto mais próximas estiverem as cargas, maior é a atracção entre elas e consequentemente maior é a entalpia da rede. Portanto, à medida que o tamanho iónico aumenta, a energia da treliça diminui. Usando a amostra acima, a entalpia de MgO é também muito maior que NaCl porque o átomo Mg é menor que Na e o átomo O é menor que Cl.
A energia da malha diminui portanto um grupo na tabela periódica.
Below há uma imagem muito útil da tabela periódica e das tendências de todas as principais forças e características dos átomos importantes. Note-se que a energia da malha aumenta no período e diminui no grupo na tabela periódica.
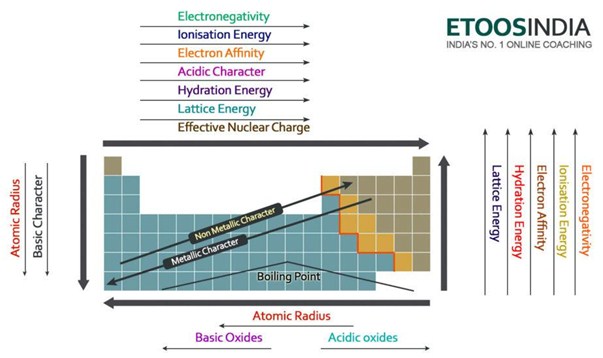
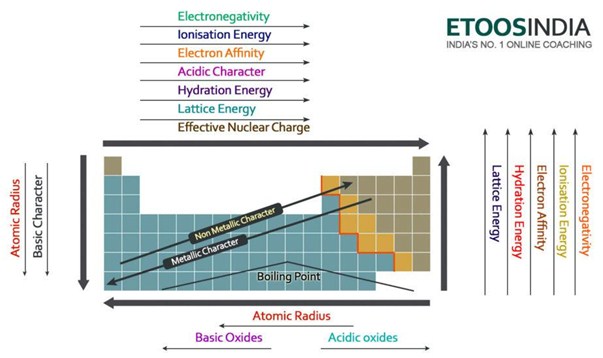
Figure2. Tendências das principais forças e propriedades dos átomos na tabela periódica. http://blog.etoosindia.com/periodic-table-trends/
Como calcular as energias de entalpia.
Para calcular a energia de entalpia é necessário estar familiarizado com a Lei de Hess:
A mudança de entalpia que acompanha uma mudança química é independente do percurso pelo qual a mudança química ocorre.
Tambem precisamos de definir a entalpia de atomização, ΔH°a:
A entalpia de atomização padrão é a mudança de entalpia quando 1 mole de átomos gasosos é formada a partir do elemento no seu estado padrão.
A mudança de entalpia de atomização é sempre positiva.
Para calcular as entalpias precisamos de seguir O ciclo Nascido-Haber. Representa uma série de passos conducentes à formação de um composto iónico a partir dos seus iões gasosos constituintes. O ciclo Born-Haber trata apenas de compostos iónicos onde os metais tendem a formar cátions, e os não metálicos formam aniões.
Vamos continuar a utilizar NaCl como nosso exemplo para explicar como funciona o ciclo Born-Haber.
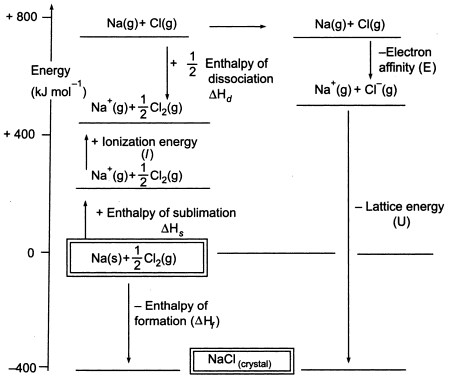
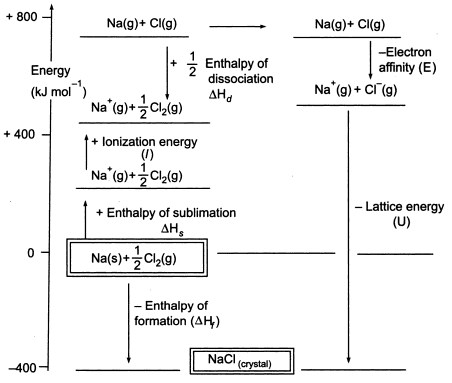
Fig3. Ciclo Nascido-Haber de NaCl
Como temos de produzir átomos gasosos para que possamos utilizar a fase seguinte do ciclo, a primeira fase do ciclo envolve a formação de metal de sódio gasoso a partir de metal de sódio sólido. Nesta etapa endotérmica, a energia de sublimação do sódio é +108 KJ.
A segunda etapa, também é endotérmica, e é a formação de um átomo de cloro a partir de uma molécula de cloro diatómico, uma vez que temos de produzir átomos gasosos para que possamos utilizar a etapa seguinte do ciclo. A energia de dissociação de ligação da molécula de cloro diatómico é +122 KJ.
A terceira etapa é a ionização do átomo de sódio gasoso para formar um íon de sódio. Como se pode esperar, a mudança de energia no processo é referida como a energia de ionização do sódio. Esta etapa é endotérmica, sendo a energia de ionização do sódio +496 KJ. As energias de ionização passam de átomos gasosos a iões positivos carregados individualmente.
A quarta etapa é a adição de um electrão a um átomo de cloro gasoso, que é definido como a afinidade dos electrões com o cloro. Este passo é exotérmico, -349 KJ. Assim, a partir da terceira e quarta etapa obtemos iões de sódio e cloreto. As afinidades dos electrões vão dos átomos gasosos aos iões negativos gasosos carregados individualmente.
Agora, o passo final é formar cristal de cloreto de sódio a partir de iões de sódio e cloreto. Os iões gasosos positivos e negativos que podemos converter em cloreto de sódio sólido utilizando a entalpia de formação da malha. Esta é a energia da malha (U), cujo valor lhe será fornecido para calcular a entalpia da malha ou H. Aqui, U de NaCl é -788 KJ.
P>Calculemos agora a entalpia da malha.
Hf = Hsublimação(Na) + Energia de ionização (Na) + Hdissociação(Cl2) + Afinidade de Electrão(Cl) + U (entalpia da malha)