Fatti chiave & Sommario:
- L’entalpia del lattice è una misura della forza delle forze tra gli ioni in un solido ionico.
- L’energia del reticolo è l’energia richiesta per separare 1 mol di un solido ionico in ioni gassosi
- L’entalpia del reticolo aumenta con le cariche e diminuisce con le dimensioni degli ioni.
- Il ciclo Born-Haber rappresenta una serie di passi che portano alla formazione di un composto ionico dai suoi costituenti ioni gassosi
Prima di tutto, cos’è il reticolo?
In chimica, quando si usa il termine reticolo, di solito ci si riferisce a un reticolo cristallino che è una sostanza altamente trasparente con una forma geometrica regolare. La disposizione tridimensionale degli atomi o degli ioni in uno schema cristallino organizzato all’interno viene definita reticolo cristallino. Per esempio, se diciamo ‘reticolo cristallino di cloruro di sodio’, intendiamo un modello geometrico regolare di ioni di sodio e cloruro.
L’entalpia del reticolo è solitamente applicabile ai composti ionici, che sono composti formati da metalli e non-metalli. I valori dell’entalpia del lattice (H) sono solitamente rappresentati in kilojoule (KJ). L’entalpia del reticolo e l’energia del reticolo sono comunemente usate come se significassero esattamente la stessa cosa, anche se c’è una differenza tra loro che riguarda le condizioni in cui sono calcolate.
L’energia del reticolo è l’energia richiesta per separare 1 mol di un solido ionico in ioni gassosi.
Se prendiamo NaCl come esempio e vogliamo preparare il reticolo di cristalli di cloruro di sodio, l’entalpia del reticolo del cloruro di sodio sarà l’energia necessaria per formare un cristallo solido di cloruro di sodio dagli ioni gassosi di sodio e cloruro.
La formazione di un cristallo solido di solito rilascia un’enorme quantità di energia nell’ambiente; quindi, il processo è esotermico, e quindi il suo valore è sempre negativo.
Na (s) +1 Cl2 → NaCl (s) ΔH = – 411KJ
L’entalpia del lattice è una misura della forza delle forze tra gli ioni in un solido ionico. Maggiore è l’entalpia del reticolo, più forti sono le forze, e maggiore è l’energia rilasciata nell’ambiente quando il cristallo si forma. Questa energia viene rilasciata quando si formano i legami ed è necessaria per rompere i legami. Questa forza cessa di esistere solo quando il sale è allo stato gassoso, quindi quando gli ioni sono troppo lontani tra loro.
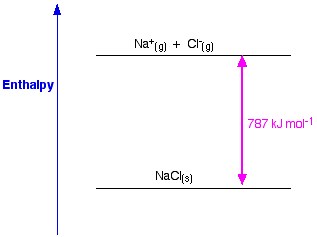
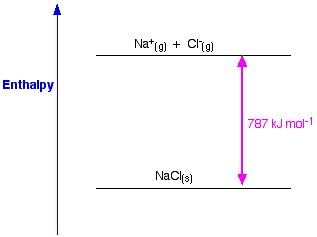
Figura 1. Entalpia del lattice di NaCl. Www.chemguide.co.uk.
I principali fattori che influenzano l’entalpia del reticolo sono la carica degli ioni e i raggi degli ioni. Analizziamoli uno per uno.
CARICHE DEGLI IONI
Maggiore è la carica degli ioni, maggiore è l’attrazione tra loro, e di conseguenza maggiore è l’entalpia del reticolo. Per esempio, il cloruro di sodio NaCl e l’ossido di magnesio MgO hanno esattamente la stessa disposizione degli ioni, ma le entalpie del reticolo sono molto diverse. Siccome Mg ha 2 cariche positive +2, attraggono le cariche negative O -2 più della carica di Na + 1 che attrae solo una carica negativa Cl – 1 .
RADICI DEGLI IONI
Più piccolo è il raggio degli ioni, più vicine sono le cariche, maggiore è l’attrazione tra loro e di conseguenza maggiore è l’entalpia del reticolo. Pertanto, all’aumentare della dimensione ionica, l’energia del reticolo diminuisce. Usando l’esempio sopra, l’entalpia di MgO è anche molto più grande di quella di NaCl perché l’atomo di Mg è più piccolo di Na e l’atomo di O è più piccolo di Cl.
L’energia di reticolo quindi diminuisce lungo un gruppo sulla tavola periodica.
Di seguito c’è un’immagine molto utile della tavola periodica e le tendenze di tutte le principali forze e caratteristiche degli atomi. Notate che l’energia reticolare aumenta nel periodo e diminuisce nel gruppo sulla tavola periodica.
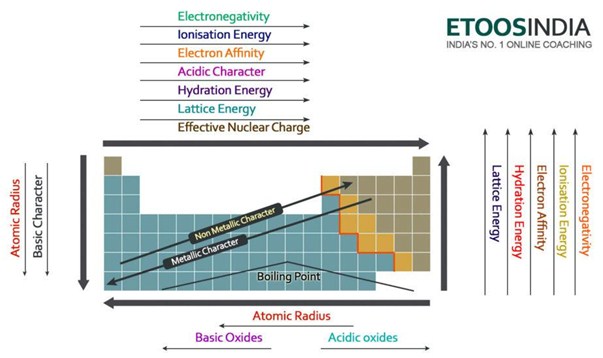
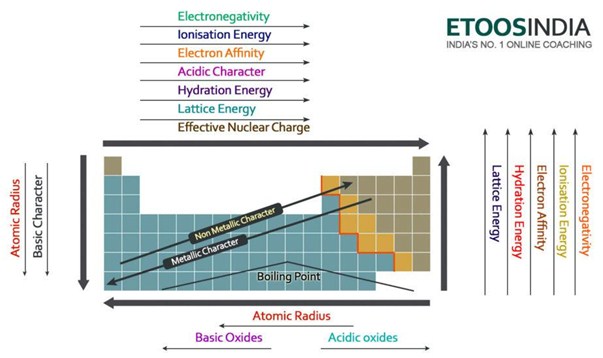
Figura2. Tendenze delle principali forze e proprietà degli atomi nella tavola periodica. http://blog.etoosindia.com/periodic-table-trends/
Come calcolare le energie entalpiche.
Per calcolare l’energia entalpica è necessario conoscere la legge di Hess:
Il cambiamento entalpico che accompagna un cambiamento chimico è indipendente dal percorso con cui avviene il cambiamento chimico.
Dobbiamo anche definire l’entalpia di atomizzazione, ΔH°a:
L’entalpia di atomizzazione standard è la variazione di entalpia quando 1 mole di atomi gassosi si forma dall’elemento nel suo stato standard.
La variazione di entalpia di atomizzazione è sempre positiva.
Per calcolare le entalpie dobbiamo seguire il ciclo Born-Haber. Rappresenta una serie di passi che portano alla formazione di un composto ionico dai suoi ioni gassosi costituenti.Il ciclo Born-Haber si occupa solo di composti ionici dove i metalli tendono a formare cationi, e i non-metalli formano anioni.
Continuiamo a usare NaCl come esempio per spiegare come funziona il ciclo Born-Haber.
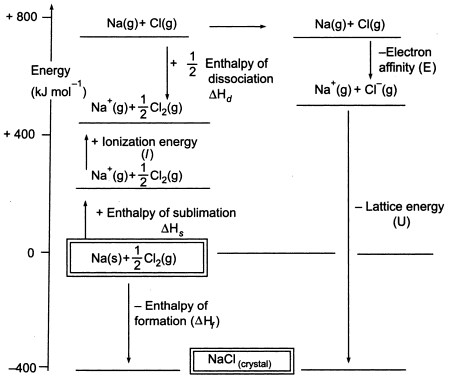
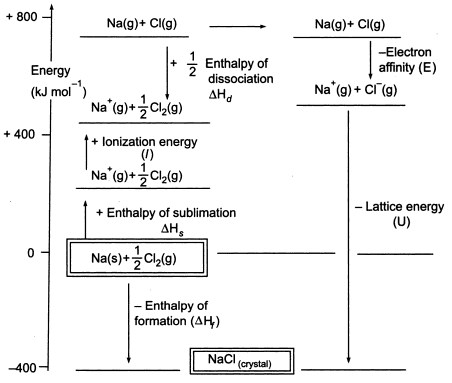
Fig3. Ciclo Born-Haber di NaCl
Poiché dobbiamo produrre atomi gassosi per poter utilizzare la fase successiva del ciclo, il primo passo del ciclo comporta la formazione di sodio metallico gassoso dal sodio metallico solido. In questo passo endotermico, l’energia di sublimazione del sodio è +108 KJ.
Il secondo passo, anch’esso endotermico, è la formazione di un atomo di cloro da una molecola biatomica di cloro, poiché dobbiamo produrre atomi gassosi in modo da poter utilizzare lo stadio successivo del ciclo. L’energia di dissociazione del legame della molecola di cloro biatomico è +122 KJ.
La terza fase è la ionizzazione dell’atomo di sodio gassoso per formare uno ione di sodio. Come ci si può aspettare, il cambiamento di energia nel processo è indicato come l’energia di ionizzazione del sodio. Questo passo è endotermico, con l’energia di ionizzazione del sodio che è +496 KJ. Le energie di ionizzazione passano da atomi gassosi a ioni gassosi singolarmente carichi positivi.
Il quarto passo è l’aggiunta di un elettrone a un atomo di cloro gassoso, che è definito come l’affinità elettronica del cloro. Questo passo è esotermico, -349 KJ. Quindi, dal terzo e dal quarto passo otteniamo ioni sodio e cloruro. Le affinità elettroniche passano da atomi gassosi a ioni gassosi singolarmente carichi negativi.
Ora, il passo finale è quello di formare cristalli di cloruro di sodio da ioni di sodio e cloruro. Gli ioni gassosi positivi e negativi che possiamo convertire nel cloruro di sodio solido usando l’entalpia di formazione del reticolo. Questa è l’energia del reticolo (U), il cui valore vi sarà fornito per calcolare l’entalpia del reticolo o H. Qui, U di NaCl è -788 KJ.
Calcoliamo ora l’entalpia del reticolo.
Hf = Hsublimazione(Na) + Energia di ionizzazione (Na) + Hdissociazione(Cl2) + Affinità elettronica(Cl) + U (entalpia del reticolo)