Kluczowe fakty & Podsumowanie:
- Entalpia sieciowa jest miarą siły sił pomiędzy jonami w ciele stałym jonowym.
- Energia kraty to energia potrzebna do rozdzielenia 1 molowego ciała stałego jonowego na jony gazowe
- Entalpia kraty rośnie wraz z ładunkami i maleje wraz z rozmiarem jonów
- Cykl Borna-Habera reprezentuje serię kroków prowadzących do utworzenia związku jonowego z jego składowych jonów gazowych
Po pierwsze, co to jest krata?
W chemii, kiedy używamy terminu kraty, zwykle odnosimy się do sieci krystalicznej, która jest wysoce przezroczystą substancją o regularnym kształcie geometrycznym. Trójwymiarowe ułożenie atomów lub jonów w zorganizowany wzór krystaliczny wewnątrz jest określane jako sieć krystaliczna. Na przykład, jeśli mówimy „krystaliczna sieć chlorku sodu”, mamy na myśli regularny geometryczny wzór jonów sodu i chlorku.
Entalpia sieciowa jest zwykle stosowana do związków jonowych, które są związkami utworzonymi przez metale i niemetale. Wartości entalpii sieciowej (H) są zwykle przedstawiane w kilodżulach (KJ). Entalpia i energia sieciowa są powszechnie używane tak, jakby oznaczały dokładnie to samo, chociaż istnieje między nimi różnica, która odnosi się do warunków, w jakich są obliczane.
Energia sieciowa jest energią wymaganą do rozdzielenia 1 molowego jonowego ciała stałego na jony gazowe.
Jeśli weźmiemy jako przykład NaCl i chcemy przygotować sieć krystaliczną chlorku sodu, entalpia sieciowa chlorku sodu będzie energią potrzebną do utworzenia stałego kryształu chlorku sodu z gazowych jonów sodu i chlorku.
Powstanie stałego kryształu zwykle uwalnia do otoczenia ogromną ilość energii, dlatego proces ten jest egzotermiczny, a więc jego wartość jest zawsze ujemna.
Na (s) +1 Cl2 → NaCl (s) ΔH = – 411KJ
Entalpia sieciowa jest miarą siły sił pomiędzy jonami w ciele stałym jonowym. Im większa entalpia sieciowa, tym silniejsze są siły i tym większa jest energia uwalniana w środowisku podczas tworzenia kryształu. Energia ta uwalnia się podczas tworzenia wiązań i jest potrzebna do ich zerwania. Siła ta przestaje istnieć tylko wtedy, gdy sól znajduje się w stanie gazowym, a więc gdy jony są rozproszone zbyt daleko od siebie.
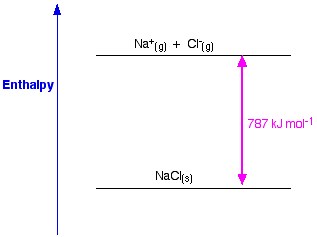
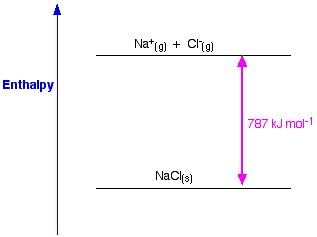
Rysunek 1. Entalpia sieciowa NaCl. Www.chemguide.co.uk.
Głównymi czynnikami wpływającymi na entalpię sieciową są ładunek jonów i promienie jonów. Przeanalizujmy je po kolei.
Ładunki jonów
Im większe są ładunki jonów, tym większe jest przyciąganie między nimi, a co za tym idzie większa jest entalpia sieciowa. Na przykład chlorek sodu NaCl i tlenek magnezu MgO mają dokładnie taki sam układ jonów, ale entalpie sieciowe są bardzo różne. Ponieważ Mg ma 2 ładunki dodatnie +2, przyciągają one ładunki ujemne O -2 bardziej niż ładunek Na + 1 przyciągający tylko jeden ładunek ujemny Cl – 1 .
Promień jonów
Im mniejszy jest promień jonów, im bliżej znajdują się ładunki, tym większe jest przyciąganie między nimi i w konsekwencji większa jest entalpia sieciowa. Dlatego też wraz ze wzrostem wielkości jonów maleje energia sieciowa. Używając powyższego przykładu, entalpia MgO jest również znacznie większa niż NaCl, ponieważ atom Mg jest mniejszy niż Na, a atom O jest mniejszy niż Cl.
Energia sieciowa maleje zatem w dół grupy na układzie okresowym.
Poniżej znajduje się bardzo użyteczny obraz układu okresowego i tendencji wszystkich głównych ważnych sił i cech atomów. Zauważ, że energia sieci wzrasta w okresie i maleje w grupie na układzie okresowym.
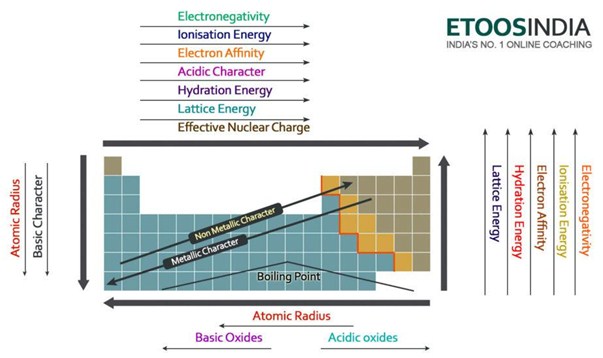
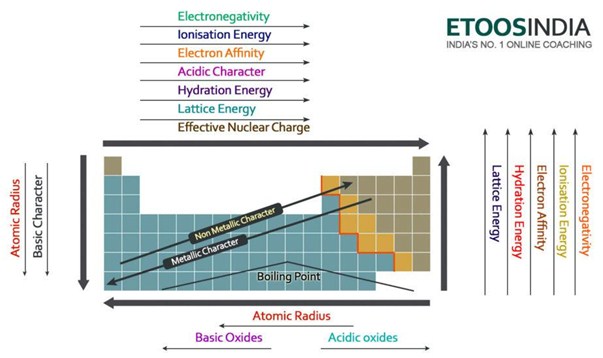
Figura2. Trendy głównych sił i właściwości atomów w układzie okresowym. http://blog.etoosindia.com/periodic-table-trends/
Jak obliczać energie entalpii.
Do obliczenia energii entalpii niezbędna jest znajomość prawa Hessa:
Zmiana entalpii towarzysząca przemianie chemicznej jest niezależna od drogi, na której zachodzi przemiana chemiczna.
Potrzebujemy również zdefiniować entalpię atomizacji, ΔH°a:
Standardowa entalpia atomizacji to zmiana entalpii przy utworzeniu 1 mola atomów gazowych z pierwiastka w jego stanie standardowym.
Zmiana entalpii atomizacji jest zawsze dodatnia.
Aby obliczyć entalpie musimy prześledzić cykl Borna-Habera. Przedstawia on szereg kroków prowadzących do powstania związku jonowego z jego składowych jonów gazowych. Cykl Borna-Habera dotyczy tylko związków jonowych, w których metale mają tendencję do tworzenia kationów, a niemetale – anionów.
Pozostańmy przy NaCl jako naszym przykładzie, aby wyjaśnić jak działa cykl Borna-Habera.
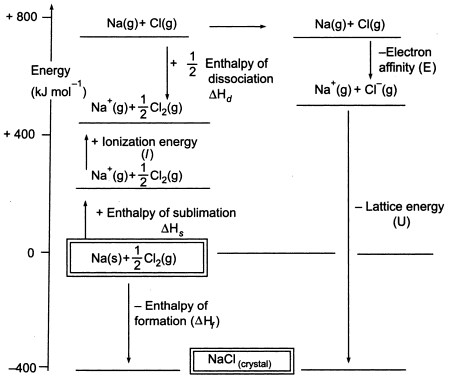
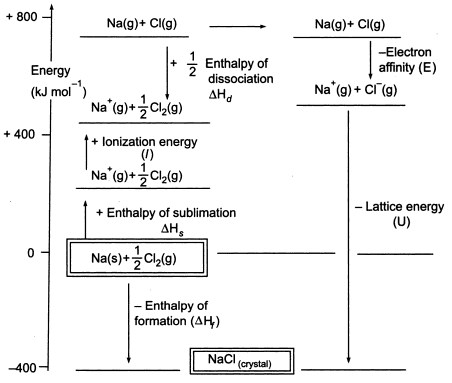
Fig3. Cykl Borna-Habera dla NaCl
Ponieważ musimy wytworzyć atomy gazowe, aby móc wykorzystać kolejny etap cyklu, pierwszy etap cyklu polega na utworzeniu gazowego sodu ze stałego sodu. W tym endotermicznym etapie energia sublimacji sodu wynosi +108 KJ.
Drugi etap, również endotermiczny, polega na utworzeniu atomu chloru z dwuatomowej cząsteczki chloru, ponieważ musimy wytworzyć atomy gazowe, aby móc wykorzystać następny etap cyklu. Energia dysocjacji wiązania dwuatomowej cząsteczki chloru wynosi +122 KJ.
Trzecim etapem jest jonizacja gazowego atomu sodu do postaci jonu sodowego. Jak można się spodziewać, zmiana energii w tym procesie jest określana jako energia jonizacji sodu.
Ten etap jest endotermiczny, a energia jonizacji sodu wynosi +496 KJ. Energie jonizacji przechodzą od gazowych atomów do gazowych pojedynczo naładowanych jonów dodatnich.
Czwarty etap to dodanie elektronu do gazowego atomu chloru, co określa się jako powinowactwo elektronowe chloru. Ten etap jest egzotermiczny, -349 KJ. Tak więc z trzeciego i czwartego etapu otrzymujemy jony sodowe i chlorkowe. Powinowactwo elektronowe przechodzi z gazowych atomów do gazowych pojedynczo naładowanych jonów ujemnych.
Teraz ostatnim krokiem jest utworzenie kryształu chlorku sodu z sodu i jonów chlorkowych. Dodatnie i ujemne jony gazowe, które możemy przekształcić w stały chlorek sodu za pomocą entalpii tworzenia sieci. Jest to energia sieciowa (U), której wartość podamy do obliczenia entalpii sieciowej lub H. Tutaj U NaCl wynosi -788 KJ.
Obliczmy teraz entalpię sieciową.
Hf = Hsublimacja(Na) + Energia jonizacji (Na) + Hdysocjacja(Cl2) + Przynależność elektronowa(Cl) + U (entalpia sieciowa)