Key Facts & Summary:
- Lattice Enthalpy ist ein Maß für die Stärke der Kräfte zwischen den Ionen in einem ionischen Festkörper.
- Gitterenergie ist die Energie, die benötigt wird, um 1 mol eines ionischen Festkörpers in gasförmige Ionen zu zerlegen
- Die Gitterenthalpie steigt mit den Ladungen und sinkt mit der Größe der Ionen.
- Der Born-Haber-Zyklus stellt eine Reihe von Schritten dar, die zur Bildung einer ionischen Verbindung aus ihren gasförmigen Bestandteilen führen
Zunächst einmal: Was ist ein Gitter?
Wenn in der Chemie von einem Gitter gesprochen wird, ist meist ein Kristallgitter gemeint, das eine hochtransparente Substanz mit einer regelmäßigen geometrischen Form ist. Die 3-dimensionale Anordnung von Atomen oder Ionen in einem organisierten kristallinen Muster darin wird als Kristallgitter bezeichnet. Wenn wir zum Beispiel von einem Natriumchlorid-Kristallgitter sprechen, meinen wir ein regelmäßiges geometrisches Muster aus Natrium- und Chlorid-Ionen.
Die Gitterenthalpie ist in der Regel auf ionische Verbindungen anwendbar, also auf Verbindungen, die aus Metallen und Nichtmetallen bestehen. Die Werte der Gitterenthalpie (H) werden üblicherweise in Kilojoule (KJ) angegeben. Gitterenthalpie und Gitterenergie werden häufig so verwendet, als ob sie genau das Gleiche bedeuten, obwohl es einen Unterschied zwischen ihnen gibt, der sich auf die Bedingungen bezieht, unter denen sie berechnet werden.
Die Gitterenergie ist die Energie, die benötigt wird, um 1 mol eines ionischen Festkörpers in gasförmige Ionen zu trennen.
Wenn wir NaCl als Beispiel nehmen und ein Natriumchlorid-Kristallgitter herstellen wollen, ist die Gitterenthalpie von Natriumchlorid die Energie, die notwendig ist, um aus gasförmigen Natrium- und Chlorid-Ionen einen festen Natriumchlorid-Kristall zu bilden.
Bei der Bildung eines festen Kristalls wird in der Regel eine große Menge an Energie an die Umgebung abgegeben; daher ist der Prozess exotherm und sein Wert ist daher immer negativ.
Na (s) +1 Cl2 → NaCl (s) ΔH = – 411KJ
Die Gitterenthalpie ist ein Maß für die Stärke der Kräfte zwischen den Ionen in einem ionischen Festkörper. Je größer die Gitterenthalpie ist, desto stärker sind die Kräfte und desto höher ist die Energie, die bei der Bildung des Kristalls an die Umgebung abgegeben wird. Diese Energie wird beim Eingehen von Bindungen freigesetzt und wird zum Aufbrechen von Bindungen benötigt. Diese Kraft ist nur dann nicht mehr vorhanden, wenn sich das Salz im gasförmigen Zustand befindet, also wenn die Ionen zu weit voneinander entfernt sind.
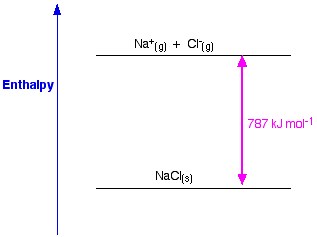
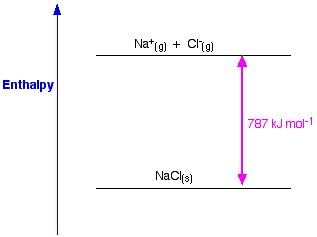
Abbildung 1. Gitter-Enthalpie von NaCl. Www.chemguide.co.uk.
Die Hauptfaktoren, die die Gitterenthalpie beeinflussen, sind die Ionenladung und die Ionenradien. Analysieren wir sie einzeln.
Ladungen der Ionen
Je größer die Ladungen der Ionen sind, desto größer ist die Anziehungskraft zwischen ihnen, und folglich ist die Gitterenthalpie umso größer. Zum Beispiel haben Natriumchlorid NaCl und Magnesiumoxid MgO genau die gleiche Anordnung der Ionen, aber die Gitterenthalpien sind sehr unterschiedlich. Da Mg 2 positive Ladungen +2 hat, ziehen sie die negativen Ladungen O -2 stärker an als die Ladung von Na + 1, die nur ein negatives Cl – 1 anzieht.
Ionenradius
Je kleiner der Radius der Ionen ist, desto näher liegen die Ladungen beieinander, desto größer ist die Anziehung zwischen ihnen und folglich ist die Gitterenthalpie größer. Daher nimmt die Gitterenergie mit zunehmender Ionengröße ab. Anhand des obigen Beispiels ist die Enthalpie von MgO auch viel größer als die von NaCl, weil das Mg-Atom kleiner als Na und das O-Atom kleiner als Cl ist.
Die Gitterenergie nimmt daher eine Gruppe nach unten im Periodensystem ab.
Unten ist ein sehr nützliches Bild des Periodensystems und die Trends aller wichtigen Kräfte und Eigenschaften der Atome. Beachten Sie, dass die Gitterenergie in der Periode zunimmt und in der Gruppe auf dem Periodensystem abnimmt.
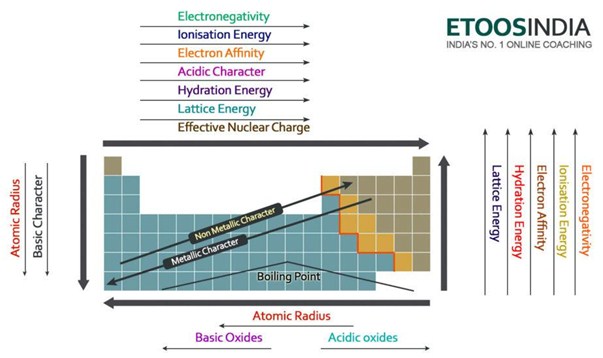
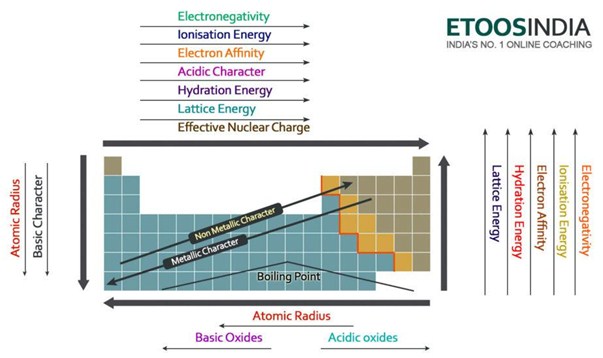
Abbildung2. Trends der Hauptkräfte und Atomeigenschaften im Periodensystem. http://blog.etoosindia.com/periodic-table-trends/
Wie man Enthalpie-Energien berechnet.
Um die Enthalpie-Energie zu berechnen, ist es notwendig, mit dem Hess’schen Gesetz vertraut zu sein:
Die Enthalpie-Änderung, die eine chemische Änderung begleitet, ist unabhängig von dem Weg, auf dem die chemische Änderung stattfindet.
Wir müssen auch die Zerstäubungsenthalpie, ΔH°a, definieren:
Die Standard-Zerstäubungsenthalpie ist die Enthalpieänderung, wenn 1 Mol gasförmiger Atome aus dem Element in seinem Standardzustand gebildet wird.
Die Enthalpieänderung der Zerstäubung ist immer positiv.
Um die Enthalpien zu berechnen, müssen wir dem Born-Haber-Zyklus folgen. Der Born-Haber-Zyklus befasst sich nur mit ionischen Verbindungen, wobei Metalle dazu neigen, Kationen zu bilden, und Nichtmetalle Anionen bilden.
Lassen Sie uns weiter am Beispiel von NaCl erklären, wie der Born-Haber-Zyklus funktioniert.
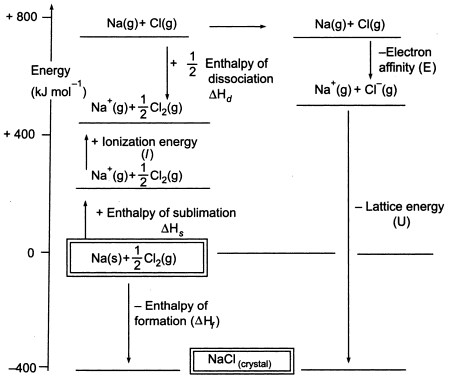
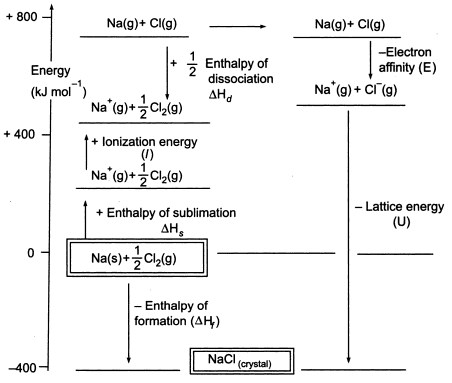
Abbildung3. Born-Haber-Zyklus von NaCl
Da wir gasförmige Atome erzeugen müssen, um die nächste Stufe im Zyklus nutzen zu können, beinhaltet der erste Schritt im Zyklus die Bildung von gasförmigem Natriummetall aus festem Natriummetall. In diesem endothermen Schritt beträgt die Sublimationsenergie des Natriums +108 KJ.
Der zweite Schritt ist ebenfalls endotherm und besteht in der Bildung eines Chloratoms aus einem zweiatomigen Chlormolekül, da wir gasförmige Atome erzeugen müssen, um die nächste Stufe im Zyklus nutzen zu können. Die Bindungsdissoziationsenergie des zweiatomigen Chlormoleküls beträgt +122 KJ.
Der dritte Schritt ist die Ionisation des gasförmigen Natriumatoms zur Bildung eines Natriumions. Wie zu erwarten, wird die Energieänderung bei diesem Vorgang als Ionisierungsenergie des Natriums bezeichnet.
Dieser Schritt ist endotherm, die Ionisierungsenergie des Natriums beträgt +496 KJ. Die Ionisierungsenergien gehen von gasförmigen Atomen zu gasförmigen einfach geladenen positiven Ionen.
Der vierte Schritt ist die Anlagerung eines Elektrons an ein gasförmiges Chloratom, was als Elektronenaffinität von Chlor bezeichnet wird. Dieser Schritt ist exotherm, -349 KJ. Aus dem dritten und dem vierten Schritt erhalten wir also Natrium- und Chloridionen. Die Elektronenaffinitäten gehen von gasförmigen Atomen zu gasförmigen einfach geladenen negativen Ionen über.
Im letzten Schritt wird nun aus Natrium- und Chlorid-Ionen ein Natriumchlorid-Kristall gebildet. Die positiven und negativen gasförmigen Ionen können wir mit Hilfe der Gitterbildungsenthalpie in das feste Natriumchlorid umwandeln. Dies ist die Gitterenergie (U), deren Wert Ihnen zur Berechnung der Gitterenthalpie oder H zur Verfügung gestellt wird. Hier ist U von NaCl -788 KJ.
Lassen Sie uns nun die Gitterenthalpie berechnen.
Hf = HSublimation(Na) + Ionisierungsenergie (Na) + HDissoziation(Cl2) + Elektronenaffinität(Cl) + U (Gitterenthalpie)